
1.反应焓变与反应方向
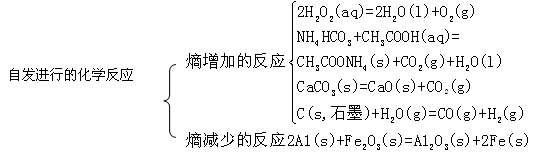
(1)多数能自发进行的化学反应是放热反应。如氢氧化亚铁的水溶液在空气中被氧化为氢氧化铁的反应是自发的,其△H(298K)==-444.3kJ·mol—1
(2)部分吸热反应也能自发进行。
如NH4HCO3(s)+CH3COOH(aq)==CH3COONH4(aq)+CO2(g)+H2O(l),其△H(298K)== +37.30kJ·mol—1。
(3)有一些吸热反应在常温下不能自发进行,在较高温度下则能自发进行。如碳酸钙的分解。
因此,反应焓变不是决定反应能否自发进行的唯一依据。
4.活化能:对基元反应而言,活化分子的平均能量与普通反应物分子的平均能量之差叫该反应的活化能(用Ea表示,其单位为kJ/mol)。活化能越大,反应越难进行。
催化剂能降低化学反应的活化能,增大活化分子的百分数,进而增大化学反应速率。催化剂具有选择性。
解释化学反应速率快慢的链条思维:活化能→活化分子→有效碰撞→化学反应速率。
 影响 影响外因 |
单位体积内 |
有效碰撞次数 |
化学反应速率 |
||
|
分子总数 |
活化分子数 |
活化分子百分数 |
|||
|
增大反应物浓度 |
增加 |
增加 |
不变 |
增加 |
加快 |
|
增大压强 |
增加 |
增加 |
不变 |
增加 |
加快 |
|
升高温度 |
不变 |
增加 |
增大 |
增加 |
加快 |
|
使用催化剂 |
不变 |
增加 |
增大 |
增加 |
加快 |
|

[例1](2010福建卷,12)化合物Bilirubin在一定波长的光照射下发生分解反应,反应物尝试随反应时间变化如右图所示,计算反应4~8 min间的平均反应速率和推测反应16 min 反应物的浓度,结果应是

A 2.5 和2.0
和2.0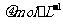
B 2.5 和2.5
和2.5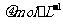
C 3.0 和3.0
和3.0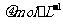
D 3.0 和3.0
和3.0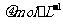
解析:本题考察化学反应速率的计算
第8秒与第4秒时反应物浓度差△C为10 ,
, 为4秒,所以在4~8
为4秒,所以在4~8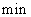 间的平均反应速率为2.5
间的平均反应速率为2.5 ,可以排除CD两个答案;图中从0
,可以排除CD两个答案;图中从0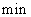 开始到8
开始到8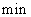 反应物浓度减低了4倍,根据这一幅度,可以推测从第8
反应物浓度减低了4倍,根据这一幅度,可以推测从第8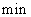 到第16分也降低4倍,即由10
到第16分也降低4倍,即由10 降低到2.5
降低到2.5 ,因此推测第16
,因此推测第16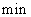 反应物的浓度为2.5
反应物的浓度为2.5 ,所以可以排除A而选B
,所以可以排除A而选B
答案:B
[例2](2010全国卷1,27)
(15分)在溶液中,反应A+2B C分别在三种不同实验条件下进行,它们的起始浓度均为
C分别在三种不同实验条件下进行,它们的起始浓度均为 、
、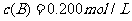 及
及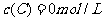 。反应物A的浓度随时间的变化如下图所示。
。反应物A的浓度随时间的变化如下图所示。
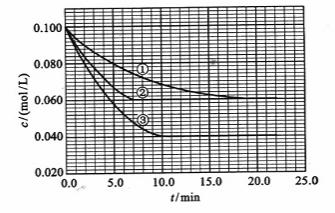
请回答下列问题:
(1)与①比较,②和③分别仅改变一种反应条件。所改变的条件和判断的理由是:
②_______________;
③_______________;
(2)实验②平衡时B的转化率为_________;实验③平衡时C的浓度为____________;
(3)该反应的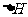 _________0,判断其理由是__________________________________;
_________0,判断其理由是__________________________________;
(4)该反应进行到4.0min时的平均反应速度率:
实验②: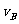 =__________________________________;
=__________________________________;
实验③: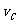 =__________________________________。
=__________________________________。
[解析](1)②使用了(正)催化剂;理由:因为从图像可看出,两者最终的平衡浓度相同,即最终的平衡状态相同,而②比①所需要的时间短,显然反应速率加快了,故由影响反应速率和影响平衡的因素可知是加入(正)催化剂;③升高温度;理由:因为该反应是在溶液中进行的反应,所以不可能是改变压强引起速率的改变,又由于各物质起始浓度相同,故不可能是改变浓度影响反应速率,再由于③和①相比达平衡所需时间短,平衡时浓度更小,故不可能是改用催化剂,而只能是升高温度来影响反应速率的
(2)不妨令溶液为1L,则②中达平衡时A转化了0.04mol,由反应计量数可知B转化了0.08mol,所以B转化率为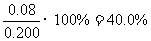 ;同样在③中A转化了0.06mol,则生成C为0.06mol,体积不变,即平衡时C(c)=0.06mol/L
;同样在③中A转化了0.06mol,则生成C为0.06mol,体积不变,即平衡时C(c)=0.06mol/L
(3) 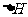 ﹥0;理由:由③和①进行对比可知升高温度后A的平衡浓度减小,即A的转化率升高,平衡向正方向移动,而升温是向吸热的方向移动,所以正反应是吸热反应,
﹥0;理由:由③和①进行对比可知升高温度后A的平衡浓度减小,即A的转化率升高,平衡向正方向移动,而升温是向吸热的方向移动,所以正反应是吸热反应,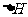 ﹥0
﹥0
(4)从图上读数,进行到4.0min时,实验②的A的浓度为:0.072mol/L,则△C(A)=0.10-0.072=0.028mol/L,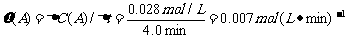 ,∴
,∴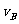 =2
=2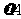 =0.014mol(L·min)-1;进行到4.0mi实验③的A的浓度为:0.064mol/L:△C(A,) =0.10-0.064=0.036mol/L,
=0.014mol(L·min)-1;进行到4.0mi实验③的A的浓度为:0.064mol/L:△C(A,) =0.10-0.064=0.036mol/L,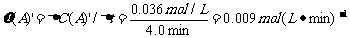 ,∴
,∴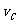 =
=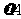 =0.0089mol(L·min)-1
=0.0089mol(L·min)-1
[答案](1)②加催化剂;达到平衡的时间缩短,平衡时A的浓度未变
③温度升高;达到平衡的时间缩短,平衡时A的浓度减小
(2)40%(或0.4);0.06mol/L;(3)﹥;升高温度向正方向移动,故该反应是吸热反应
(4)0.014mol(L·min)-1;0.008mol(L·min)-1
[命题意图]考查基本理论中的化学反应速率化学平衡部分,一些具体考点是:易通过图像分析比较得出影响化学反应速率和化学平衡的具体因素(如:浓度,压强,温度,催化剂等)、反应速率的计算、平衡转化率的计算,平衡浓度的计算,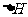 的判断;以及计算能力,分析能力,观察能力和文字表述能力等的全方位考查。
的判断;以及计算能力,分析能力,观察能力和文字表述能力等的全方位考查。
[点评]本题所涉及的化学知识非常基础,但是能力要求非常高,观察和分析不到位,就不能准确的表述和计算,要想此题得满分必须非常优秀才行!此题与2009年全国卷II理综第27题,及安微卷理综第28题都极为相似,有异曲同工之妙,所以对考生不陌生!
|

第2课时 化学反应的方向及判据
2.影响反应速率的因素
内因:反应物的性质是反应速率大小的决定因素。
外因:主要因素有浓度、温度、压强、催化剂等。
(1)浓度:其它条件不变时,增大反应物浓度,化学反应速率加快。
(2)温度:其它条件不变时,升高温度,化学反应速率加快。一般来说,温度每升高10℃,反应速率增大为原来的2-4倍。
(3)压强:其它条件不变时,增大压强,对于有气体物质参加的化学反应,反应速率加快。
(4)催化剂:使用正催化剂,能加快反应速率。未特别指明时,均指正催化剂。
1.化学反应速率的表示方法:通常用单位时间内反应物浓度的减少或者生成物浓度的增加来表示化学反应速率。单位:mol/L·s ;mol/L·min ;mol/L·h等。
对于任一化学反应:aA +bB==cC +dD可用υ(A)、υ(B)、υ(C)、υ(D)表示其速率,则有υ(A):υ(B):υ(C):υ(D)== a:b:c:d,即化学反应速率之比等于化学方程式中各物质的系数之比(还可等于其学其浓度变化之比或物质的量变化之比)。
2、熵:描述体系滋乱度的物理理 单位:J.mol-1 .k-1 符号S
影响熵的因素:①同一条件下,不同物质熵不同②同一物质,聚集状态不同熵不同S(g)>S(l)>S(s)
反应的熵变(△S):△S=S反应产物-S反应物
T、P一定,反应焓变和熵变共同影响反应方向,反应方向判据:△H-T△S<0 反应能自发进行;△H-T△S=0 反应达到平衡状态;△H-T△S>0 反应不能自发进行
|

第1课时 化学反应速率
1、反应焓变是与反应能否自发进行有关的一个因素,但不是惟一因素
2.平衡移动原理:如果改变影响平衡的一个条件(如浓度、压强或温度等),平衡就向能够减弱这种改变的方向移动。它是浓度、压强和温度等外界条件对平衡移动影响的概括和总结,只适用于已经达到平衡状态的可逆反应,未处于平衡状态的体系不能用此原理分析,但它也适用于其他动态平衡体系,如溶解平衡、电离平衡和水解平衡等。催化剂能够同等程度地增加正反应速率和逆反应速率,因此它对化学平衡的移动没有影响。
1.化学平衡状态是指在一定条件下的可逆反应里,正反应和逆反应的速率相等,反应混合物中各组分的浓度保持不变的状态。 化学平衡状态的特征: (1)“逆”:化学平衡研究的对象是可逆反应,可逆反应不能进行到底,即反应过程中反应物、生成物,不能全部转化为生成物(反应物)。 (2)“动”:化学平衡是动态平衡,化学反应达平衡时正反应和逆反应仍在继续进行。 (3)“等”:指反应体系中的用同一种物质来表示的正反应速率和逆反应速率相等。对于不同种物质而言,速率不一定相等。 (4)“定”:平衡混合物中各组分的物质的量、质量、物质的量浓度,各组分的百分含量(体积分数、质量分数)、转化率等不随时间变化而改变。 (5)“变”:改变影响化学平衡的条件,平衡发生移动。 (6)化学平衡的建立与反应的途径无关。 化学平衡状态的标志是化学平衡状态特征的具体体现。
3.浓度和压强的改变仅仅改变了单位体积内活化分子的数目,温度的改变和催化剂的存在却能改变单位体积内反应物分子中活化分子所占的百分数。
2.参加反应的物质的性质是决定化学反应速率的主要因素,外界条件对化学反应速率也有影响。
(1)浓度对化学反应速率的影响只适用于气体反应或溶液中的反应;
(2)压强对化学反应速率的影响只适用于气体参加的反应;
(3)温度对化学反应速率的影响:实验测得,其他条件不变时,温度每升高10℃,化学反应速率通常增加原来的2-4倍,经验公式: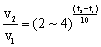 ;
(4)使用催化剂,使原来难以进行的化学反应,分步进行(本身参与了反应,但反应前后
;
(4)使用催化剂,使原来难以进行的化学反应,分步进行(本身参与了反应,但反应前后
化学性质不变),从而大幅度改变了化学反应速率。 (5)此外,光、电磁波、超声波、反应物颗粒的大小、溶剂的性质等也会对化学反应速
率产生影响。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com