
8.在一定温度下,向aL密闭容器中加入1mol X气体和2mol Y气体,发生如下反应:X(g)+2Y(g)  2Z(g),此反应达到平衡的标志是( )
A.容器内压强随时间变化而变化 B.容器内各物质的浓度不随时间变化
C.容器内X、Y、Z的浓度之比1:2:3
D.单位时间消耗0.1mol X的同时生成0.2mol Z
2Z(g),此反应达到平衡的标志是( )
A.容器内压强随时间变化而变化 B.容器内各物质的浓度不随时间变化
C.容器内X、Y、Z的浓度之比1:2:3
D.单位时间消耗0.1mol X的同时生成0.2mol Z
5.用Al粉和碘甲烷制(CH3)3Al时,于100℃搅拌65h,产率为0,若用超声波,则室温下用2.5h,产率可达96%。有关叙述中正确的是( )
A.超声波加快反应速率的作用大于搅拌 B.且超声波使铝粉于CH3中乳化成为胶体
C.超声波使化学反应物局部急骤升温 D.超声波加快CH3I分解为碘和甲烷
6.在一定温度下的定容密闭容器中,当下列物理量不再发生变化时,表示反应A(s)+2B(g)  C(g)+D(g)已达到平衡状态的是( )
A.混合气体密度 B.混合气体的压强
C.混合气体的总物质的量 D.B的物质的量浓度
7.下图I、Ⅱ、Ⅲ分别代表反应①③、②、④则Y轴是指( )
C(g)+D(g)已达到平衡状态的是( )
A.混合气体密度 B.混合气体的压强
C.混合气体的总物质的量 D.B的物质的量浓度
7.下图I、Ⅱ、Ⅲ分别代表反应①③、②、④则Y轴是指( )
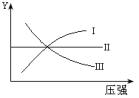
①N2+3H2 2NH3;△H<0 ②H2+I2(g)
2NH3;△H<0 ②H2+I2(g)  2HI;△H<0
③CO+2H2=CH3OH;△H<0 ④2SO3
2HI;△H<0
③CO+2H2=CH3OH;△H<0 ④2SO3 2SO2+O2;△>0
A.平衡混合气中一种生成物的百分含量 B.平衡混合气中一种反应物的百分含量
C.平衡混合气中一种生成物的转化率 D.平衡混合气中一种反应物的转化率
2SO2+O2;△>0
A.平衡混合气中一种生成物的百分含量 B.平衡混合气中一种反应物的百分含量
C.平衡混合气中一种生成物的转化率 D.平衡混合气中一种反应物的转化率
4.在恒温恒容下,某容器中进行如下反应:H2 2H。若反应物的浓度由0.1mol·L-1降到0.06mol·L-1需20s,那么由0.06mol·L-1降到0.024mol·L-1需反应的时间为( )
A.等于18s B.等于12s C.大于18s D.小于18s
2H。若反应物的浓度由0.1mol·L-1降到0.06mol·L-1需20s,那么由0.06mol·L-1降到0.024mol·L-1需反应的时间为( )
A.等于18s B.等于12s C.大于18s D.小于18s
3.反应4NH3(g)+5O2(g)=4NO(g)+6H2O(g)在2L的密闭容器中进行,1min后,NH3减少了0.12mol,则平均每秒钟浓度变化正确的是( ) A.NO:0.001mol·L-1 B.H2O:0.002mol·L-1 C.NH3:0.002mol·L-1 D.O2:0.00125mol·L-1
2.将A与B的混合物15mol放人容积为2L的密闭容器里,在一定条件下发生反应:2A(气)+3B(气)  C(气)+2D(气),经过15min达到平衡,达平衡时容器内的压强是反应前的
C(气)+2D(气),经过15min达到平衡,达平衡时容器内的压强是反应前的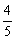 。则以B气体的浓度变化表示的反应速率是( )
A.0.15mol·L-1·min-1 B.0.3mol·L-1·min-1
C.0.45mol·L-1·min-1 D.0.6mol·L-1·min-1
。则以B气体的浓度变化表示的反应速率是( )
A.0.15mol·L-1·min-1 B.0.3mol·L-1·min-1
C.0.45mol·L-1·min-1 D.0.6mol·L-1·min-1
1.反应A(气)+3B(气)  2C(气)+2D(气)在四种不同情况下的反应速率分别如下,其中反应速率最大的是( )
A.vA=0.15mol·L-1·min-1 B.vB=0.6mol·L-1·min-1
C.vC=0.4mol·L-1·min-1 D.vD=0.01mol·L-1·s-1
2C(气)+2D(气)在四种不同情况下的反应速率分别如下,其中反应速率最大的是( )
A.vA=0.15mol·L-1·min-1 B.vB=0.6mol·L-1·min-1
C.vC=0.4mol·L-1·min-1 D.vD=0.01mol·L-1·s-1
0.40 mol·L-1c(N2)=(0.60-0.40) mol÷2.0 L=0.10 mol·L-1
c(H2)=(1.60-3×0.40) mol÷2.0 L=0.20 mol·L-1
K=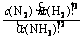 =[(0.10 mol·L-1)×(0.20 mol·L-1)3]÷(0.40 mol·L-1)2
=[(0.10 mol·L-1)×(0.20 mol·L-1)3]÷(0.40 mol·L-1)2
=5.0×10-3mol2·L-2
化学反应速率、化学平衡单元测试
2.合成氨适宜条件的选择
(1)选择依据:从提高反应速率的角度分析,提高反应温度、使用催化剂、适当提高氮氢比;从平衡移动的角度分析,降低温度、提高压强和适时分离反应产物氨;从实际生产的角度分析,温度和压强要与生产实际相适应。
(2)选择原则:能加快反应速率;提高原料的利用率;提高单位时间内的产量;对设备条件要求不能太高。
(3)合成氨的适宜条件:使用催化剂;适宜的压强:2×107-5×107Pa;适宜的温度:500℃左右;及时分离出氨和及时补充氮气和氢气。
 (4)合成氨的简要流程:
(4)合成氨的简要流程:
|

[例1](2010安徽卷)低脱硝技术可用于处理废气中的氮氧化物,发生的化学反应为:
2NH2(g)+NO(g)+NH2(g)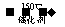 2H3(g)+3H2O(g)
2H3(g)+3H2O(g)  H<0
H<0
在恒容的密闭容器中,下列有关说法正确的是
A.平衡时,其他条件不变,升高温度可使该反应的平衡常数增大
B.平衡时,其他条件不变,增加NH3的浓度,废气中氮氧化物的转化率减小
C.单位时间内消耗NO和N2的物质的量比为1∶2时,反应达到平衡
D.其他条件不变,使用高效催化剂,废气中氮氧化物的转化率增大
答案:C
解析:A选项,放热反应升温平衡常数减小,错误;增大一个反应物浓度另一反应物转化率增大,B错;使用催化剂平衡不移动,D错。
[例2](2010重庆卷)(15分)某兴趣小组用题27图装置探究氨的催化氧化.
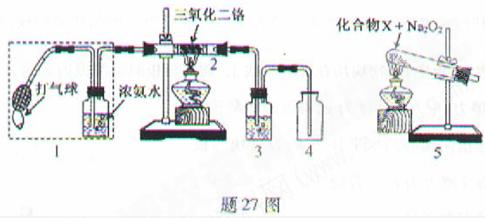
(1)氨催化氧化的化学方程式为___________________.
(2)加热玻璃管2一段时间后,挤压1中打气球鼓入空气,观察到2中物质呈红热状态;停止加热后仍能保持红热,该反应是_________反应(填“吸热”或“放热”).
(3)为保证在装置4中观察到红棕色气体,装置3应装入_________;若取消3,在4中仅观察到大量白烟,原因是___________________.
(4)为实现氨催化氧化,也可用装置5替换装置_________(填装置代号);化合物X为_________(只写一种),Na2O2的作用是___________________.
答案(15分)
(1)4NH3+5O2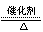 4NO+6H2O
4NO+6H2O
(2)放热
(3)浓H2SO4;生成的NO与O2反应生成NO2,NO2与水反应生成HNO3,NH3与HNO3反应生成了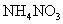
(4)I; 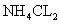 与HCL反应生成氧气(合理答案均给分)
与HCL反应生成氧气(合理答案均给分)
[解析]本题考查氨的催化氧化。(1)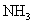 和
和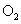 氧化生成
氧化生成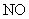 。(2)该反应为放热,故不加热后仍能保持红热状态。(3)产物中有
。(2)该反应为放热,故不加热后仍能保持红热状态。(3)产物中有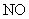 和
和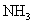 ,
,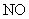 会被
会被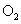 氧化生成
氧化生成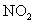 ,在于空气中的水蒸气反应生成
,在于空气中的水蒸气反应生成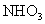 ,而
,而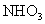 与
与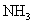 会产生白烟。(4)装置5与1均产生科产生
会产生白烟。(4)装置5与1均产生科产生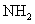 。
。 加热分解可得
加热分解可得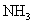 和HCL,而HCL与
和HCL,而HCL与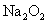 可生成
可生成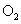 。
。
[例3](2008广东24)科学家一直致力于研究常温、常压下“人工固氮”的新方法。曾有实验报道:在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生反应,生成的主要产物为NH3。进一步研究NH3生成量与温度的关系,部分实验数据见下表(光照、N2压力1.0×105 Pa、反应时间3 h):
|
T/K |
303 |
313 |
323 |
353 |
|
NH3生成量/(10-6
mol) |
4.8 |
5.9 |
6.0 |
2.0 |
相应的热化学方程式如下:
 N2(g)+3H2O(l) 2NH3(g)+
N2(g)+3H2O(l) 2NH3(g)+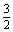 O2(g)
O2(g)
ΔH=+765.2 kJ·mol-1
回答下列问题:
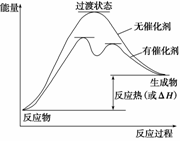
(1)请画出上述反应在有催化剂与无催化剂两种情况下反应过程中体系能量变化示意图,并进行必要标注。
(2)与目前广泛使用的工业合成氨方法相比,该方法中固氮反应速率慢。请提出可提高其反应速率且增大NH3生成量的建议: 。
 (3)工业合成氨的反应为N2(g)+3H2(g) 2NH3(g)。设在容积为2.0 L的密闭容器中充入0.60 mol N2(g)和1.60 mol H2(g),反应在一定条件下达到平衡时,NH3的物质的量分数(NH3的物质的量与反应体系中总的物质的量之比)为
(3)工业合成氨的反应为N2(g)+3H2(g) 2NH3(g)。设在容积为2.0 L的密闭容器中充入0.60 mol N2(g)和1.60 mol H2(g),反应在一定条件下达到平衡时,NH3的物质的量分数(NH3的物质的量与反应体系中总的物质的量之比)为 。计算:
。计算:
①该条件下N2的平衡转化率;
 ②该条件下反应2NH3(g) N2(g)+3H2(g)的平衡常数。
②该条件下反应2NH3(g) N2(g)+3H2(g)的平衡常数。
 答案 (1)
答案 (1)
(2)升温、增大N2浓度、不断移出生成物
(3)①66.7% ②5.0×10-3mol2·L-2
解析 (1)催化剂能降低反应的活化能,改变反应的历程,使一个高能变过程变为几个能量相对低的过程,使反应易发生。要点是有催化剂时能量低而过程阶段多了。图见答案。
(2)加快反应速率且增大NH3生成量的方法是升温、增大N2浓度、不断移出生成物。
(3)解:①设反应过程消耗xmolN2(g)。
 N2(g)+3H2(g) 2NH3(g)
N2(g)+3H2(g) 2NH3(g)
起始物质的量/mol 0.60 1.60 0
平衡物质的量/mol 0.60-x 1.60-3x 2x
平衡时反应体系总物质的量=[(0.60-x)+(1.60-3x)+2x]mol=(2.20-2x) mol
NH3(g)的物质的量分数=2x÷(2.20-2x)=
x=0.40
N2的平衡转化率=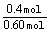 ×100%=66.7%
×100%=66.7%
 ②设反应2NH3(g) N2(g)+3H2(g)的平衡常数为K。平衡时,c(NH3)=2×0.40 mol÷2.0
L=
②设反应2NH3(g) N2(g)+3H2(g)的平衡常数为K。平衡时,c(NH3)=2×0.40 mol÷2.0
L=
1. 合成氨的反应原理:N2(g)+3H2(g) 2NH3(g)298K时,△H==92.2kJ·mol—1
合成氨的反应原理:N2(g)+3H2(g) 2NH3(g)298K时,△H==92.2kJ·mol—1
特点:合成氨是一个气体体积缩小的放热的可逆反应。
5. 反应条件对化学平衡的影响
(1)化学平衡移动:一定条件下的可逆反应达到平衡状态以后,反应条件改变,平衡混合物中各组分的浓度也随之发生改变而达到新的平衡状态,这种由一个平衡达到新的平衡的过程称为化学平衡移动。
(2)反应条件对化学平衡的影响
①改变温度:
升高温度,化学平衡向吸热反应方向移动。
降低温度,化学平衡向放热反应方向移动。
②改变浓度:
若Qc<Kc,化学平衡正向(向右)移动。
若Qc>Kc,化学平衡逆向(向左)移动。
③改变压强:
若Qp<Kp,化学平衡正向(向右)移动。
若Qp>Kp,化学平衡逆向(向左)移动。
(3)勒夏特列原理:在封闭体系中,如果只改变平衡体系中的一个条件时,平衡将向减弱这个条件改变的方向移动。
|

[例1](2010天津卷,10)
(14分)二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上可利用煤的气化产物(水煤气)合成二甲醚。
请回答下列问题:
⑴ 煤的气化的主要化学反应方程式为:___________________________。
⑵ 煤的气化过程中产生的有害气体H2S用Na2CO3溶液吸收,生成两种酸式盐,该反应的化学方程式为:________________________________________。
⑶ 利用水煤气合成二甲醚的三步反应如下:
① 2H2(g) + CO(g)  CH3OH(g);ΔH = -90.8 kJ·mol-1
CH3OH(g);ΔH = -90.8 kJ·mol-1
② 2CH3OH(g)  CH3OCH3(g) + H2O(g);ΔH= -23.5 kJ·mol-1
CH3OCH3(g) + H2O(g);ΔH= -23.5 kJ·mol-1
③ CO(g) + H2O(g)  CO2(g) + H2(g);ΔH= -41.3 kJ·mol-1
CO2(g) + H2(g);ΔH= -41.3 kJ·mol-1
总反应:3H2(g)
+ 3CO(g)  CH3OCH3(g) + CO2 (g)的ΔH= ___________;
CH3OCH3(g) + CO2 (g)的ΔH= ___________;
一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是__________(填字母代号)。
a.高温高压 b.加入催化剂 c.减少CO2的浓度
d.增加CO的浓度 e.分离出二甲醚
⑷ 已知反应②2CH3OH(g)  CH3OCH3(g) + H2O(g)某温度下的平衡常数为400 。此温度下,在密闭容器中加入CH3OH ,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g) + H2O(g)某温度下的平衡常数为400 。此温度下,在密闭容器中加入CH3OH ,反应到某时刻测得各组分的浓度如下:
|
物质 |
CH3OH |
CH3OCH3 |
H2O |
|
浓度/(mol·L-1) |
0.44 |
0.6 |
0.6 |
① 比较此时正、逆反应速率的大小:v正 ______ v逆 (填“>”、“<”或“=”)。
② 若加入CH3OH后,经10 min反应达到平衡,此时c(CH3OH) = _________;该时间内反应速率v(CH3OH) = __________。
解析:(1)煤生成水煤气的反应为C+H2O CO+H2。
CO+H2。
(2)既然生成两种酸式盐,应是NaHCO3和NaHS,故方程式为:
Na2CO3+H2S==NaHCO3+NaHS。
(3)观察目标方程式,应是①×2+②+③,故△H=2△H1+△H2+△H3=-246.4kJ· mol -1。
正反应是放热反应,升高温度平衡左移,CO转化率减小;加入催化剂,平衡不移动,转化率不变;减少CO2的浓度、分离出二甲醚,平衡右移,CO转化率增大;增大CO浓度,平衡右移,但CO转化率降低;故选c、e。
(4)此时的浓度商Q=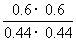 =1.86<400,反应未达到平衡状态,向正反应方向移动,故
=1.86<400,反应未达到平衡状态,向正反应方向移动,故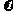 正>
正>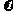 逆;设平衡时生成物的浓度为0.6+x,则甲醇的浓度为(0.44-2x)有:400=
逆;设平衡时生成物的浓度为0.6+x,则甲醇的浓度为(0.44-2x)有:400=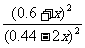 ,解得x=0.2 mol·L-1,故0.44 mol·L-1-2x=0.04 mol·L-1。
,解得x=0.2 mol·L-1,故0.44 mol·L-1-2x=0.04 mol·L-1。
由表可知,甲醇的起始浓度度为(0.44+1.2) mol·L-1=1.64 mol·L-1,其平衡浓度为0.04 mol·L-1,
10min变化的浓度为1.6 mol·L-1,故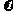 (CH3OH)=0.16 mol·L-1·min-1。
(CH3OH)=0.16 mol·L-1·min-1。
答案:(1) C+H2O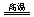 CO+H2。
CO+H2。
(2) Na2CO3+H2S==NaHCO3+NaHS
(3) -246.4kJ· mol -1 c、e
(4) ①> ②0.04 mol·L-1 0.16 mol·L-1·min-1
命题立意:本题是化学反应原理的综合性试题,考查了化学方程式的书写、盖斯定律的应用、化学平衡移动原理,和利用浓度商和平衡常数的关系判断平衡移动的方向、平衡常数和速率的计算等。
[例2](2010四川理综卷,13)
 反应aM(g)+bN(g)
反应aM(g)+bN(g) 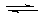 cP(g)+dQ(g)达到平衡时。M的体积分数y(M)与反应条件的关系如图所示。其中:Z表示反应开始时N的物质的量与M的物质的量之比。下列说法正确的是
cP(g)+dQ(g)达到平衡时。M的体积分数y(M)与反应条件的关系如图所示。其中:Z表示反应开始时N的物质的量与M的物质的量之比。下列说法正确的是
A.同温同压Z时,加入催化剂,平衡时Q的体积分数增加
B.同压同Z时,升高温度,平衡时Q的体积分数增加
C.同温同Z时,增加压强,平衡时Q的体积分数增加
D.同温同压时,增加Z,平衡时Q的体积分数增加。
答案:B
解析:本题考查了平衡移动原理的应用。A项加入催化剂只能改变反应速率,不会使平衡移动。B项由图像(1)知随着温度的升高M的体积分数降低,说明正反应吸热,所以温度升高平衡正向移动,Q的体积分数增加。C项对比(1)(2)可以看出相同温度条件,压强增大M的体积分数增大,所以正反应是体积缩小的反应,增大压强Q的体积分数减小。D项由C项可以判断D也不对。
[巩固练习1](福建省泉州一中2010届高三上学期期中考试)在1 L密闭容器中,把1 mol A和1 mol B混合发生如下反应:
3A(g)+B(g) xC(g)+2D(g),当反应达到平衡时,生成0.4 mol D,并测得C的平衡浓度为0.4 mol·Lˉ1,下列叙述中不正确的是
xC(g)+2D(g),当反应达到平衡时,生成0.4 mol D,并测得C的平衡浓度为0.4 mol·Lˉ1,下列叙述中不正确的是
A.x的值为2 B.A的转化率为40%
C.B的平衡浓度为0.8 mol·Lˉ1 D.D的体积分数为20%
答案 B
[巩固练习2](贵州省巴结中学2010届高三10月月考)某体积可变的密闭容器,盛有适量的A和B的混合气体,在一定条件下发生反应: ,若维持温度和压强不变,当达到平衡时,容器的体积为VL,其中C气体的体积占10%,下列推断正确 ( )
①原混合气体体积为1.2VL; ②原混合气体的体积为1.1VL;
③反应达平衡时气体A消耗0.05VL; ④反应达平衡时气体B消耗掉0.05VL。
A.②③ B.②④ C.①③ D.②①
答案 A
[巩固练习3](重庆西南师大附中2010年上学期期末考试)T℃时,A气体与B气体反应生成C气体。反应过程中A、B、C物质的量变化如图(Ⅰ)所示;若保持其他条件不变,温度分别为T1和T2时,B的体积分数与时间的关系如图(Ⅱ)所示,则下列结论正确的是( )
A.在(t1+1)min时,保持其他条件不变,增大压强,平衡向逆反应方向移动
B.在(t1+1)min时,保持容器总压强不变,通入稀有气体,平衡向正反应方向移动
C.不再增减物质,只改变压强或温度时,A的体积分数V(A)%变化范围为25%<V(A)%<40%
D.其他条件不变,升高温度,正、逆反应速率均增大,且A的转化率增大
答案 C
|

第4课时 反应速率与限度理论在化工生产上的应用
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com