
6.X和Y属短周期元素,X原子的最外层电子数是次外层电子数的一半,Y位于X的前一周期,且最外层只有一个电子,则X和Y形成的化合物的化学式可表示为 ( A )
(A)XY (B)XY2 (C)XY3 (D)X2Y3
5.X、Y、Z和R分别代表四种元素.如果aXm+、bYn+、cZn-、dRm-四种离子的电子层结构相同(a、b、c、d为元素的原子序数),则下列关系正确的是( D )
A.a-c=m-n B.a-b=n-m C.c-d=m+n D.b-d=n+m
4.X元素的阳离子和Y元素的阴离子具有与氩原子相同的电子层结构,下列叙述正确的是(CD)
A.X的原子序数比Y的小
B.X原子的最外层电子数比Y的大
C.X的原子半径比Y的大
D.X元素的最高正价比Y的小
3.据报道,1994年12月科学家发现了一种新元素,它的原子核内有161个中子,质量数为272.该元素的原子序数为 ( A )
A.111 B.161 C.272 D.433
2.178O和168O原子的核外电子数前者与后者相比 ( C )
A.大于 B.小于 C.等于 D.不能肯定
1.N和Ne的原子半径前者与后者相比( B )
A.大于 B.小于 C.等于 D.不能肯定
3、确定元素在周期表中位置的常用方法
(1)、结构简图法
本方法常用于原子序数小于20号元素或已知某微粒的核外电子排布。其步骤为:原子序数→原子结构简图→ 电子层数=周期数,最外层电子数=主族序数
例1 某主族元素的离子有6个电子层,最外层有2个电子,则X元素在周期表中的位置是( B )
(A)第六周期,第ⅡA族 (B)第六周期,第ⅣA族
(C)第七周期,第ⅡA族 (D)第七周期,第ⅥA族
变形1 某主族元素的X原子有6个电子层,最外层有2个电子,则X元素在周期表中的位置是( A )
(A)第六周期,第ⅡA族(B)第六周期,第ⅣA族
(C)第七周期,第ⅡA族 (D)第七周期,第ⅥA族
变形2 某主族元素的离子有6个电子层,最外层有8个电子,则X元素在周期表中的位置是( C )
(A)第六周期,第ⅡA族 (B)第六周期,第ⅣA族
(C)第七周期,第ⅡA族 (D)第七周期,第ⅥA族
(2)、区间定位法
对于原子序数较大,若用结构简图法,较复杂且易出错,可采用区间定位法。其原理是:
首先,要牢记各周期对应的零族元素的原子序数:
周期数 一 二 三 四 五 六 七零族元素
原子序数 2 10 18 36 54 86 118
其次,要熟悉周期表中每个纵行对应的族的序数。
族ⅠAⅡAⅢBⅣBⅤBⅥBⅦB Ⅷ ⅠB ⅡBⅢA ⅣAⅤA ⅥA ⅦA 0族
纵行1 2 3 4 5 6 7 8-10 11 12 13 14 15 16 17 18
(1)比大小,定周期。比较该元素的原子序数与零族元素的序数大小,找出与其相邻近的零族元素,那么,该元素就和序数大的零族元素处于同一周期。
(2)求差值、定族数。用该元素的原子序数减去已找出邻近的零族元素中较小的序数,所得差值即为该元素的族序数。
确定时要注意以下二点:
①短周期中因无副族元素,故所得差值即为主族序数。
②11-17纵行数的个位数与族序数相等,差值超过18时,差值再减去14后,按照上述方法即可确定族的序数。
例2 据国外有关资料报道,在独居石(一种共生矿,化学成分为Ce、La、Nb…的磷酸盐)中,查明有尚未命名的116、124、126号元素。试判断,其中116号元素的应位于周期表中的( B )
(A)第六周期ⅣA族 (B)第七周期ⅥA族
(C)第七周期Ⅷ族 (D)第八周期ⅥA族
(3)、相同电子层结构法
主族元素的阳离子与上一周期的稀有气体元素的原子电子层结构相同;主族元素的阴离子与同周期的稀有气体元素的原子电子层结构相同,要求掌握氦式结构、氖式结构、氩式结构等三种。
(1)氦式结构(2电子结构)
第一周期H- He
第二周期 Li+ Be2+
(2)氖式结构(10电子结构)
第二周期 N3- O2- F- Ne
第三周期Na+ Mg2+ Al3+
(3)氩式结构(18电子结构)
第三周期 P3- S2- Cl- Ar
第四周期 K+ Ca2+
例3 (1996年高考题)X元素的阳离子和Y元素的阴离子具有与氩原子相同的电子层结构,下列叙述正确的是( CD )
(A)X的原子序数比Y的小
(B)X原子的最外层电子数比Y的大
(C)X的原子半径比Y的大
(D)X元素的最高正价比Y的小
4)、特殊位置法
根据元素在周期表的特殊位置,如周期表中的第一行,第一列,最右上角,最左下角等来确定。
例4 短周期元素X、Y、Z在周期表中位置关系如下图。
|
|
|
X |
|
|
Y |
|
|
Z |
|
|
(1)X元素的单质其分子式是 ,若X核内中子数与质子数相等,X单质的摩尔质量 。
(2)自然界中存在的一种含Y的天然矿物的名称为
(3)Z单质的晶体类型是属于 ,Z与钠的化合物的电子式是
答案:He 4g/mol 萤石 分子晶体 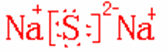
针对性练习
2.周期表中部分规律总结
(1).最外层电子数大于或等于3而又小于8的元素一定是主族元素;最外层电子数为1或2的元素可能是主族、副族或0族(He)元素;最外层电子数为8的元素是稀有气体元素(He除外)。
(2).在周期表中,第ⅡA与ⅢA族元素的原子序数差分别有以下三种情况:①第1-3周期(短周期)元素原子序数相差1;②第4、5周期相差11;③第6、7周期相差25。
(3).同主族相邻元素的原子序数差别有以下二种情况:①第ⅠA、ⅡA族,上一周期元素的原子序数+该周期元素的数目=下一同期元素的原子序数;②第ⅢA-ⅦA族,上一周期元素的原子序数+下一周期元素的数目=下一周期元素的原子序数。
(4).元素周期表中金属和非金属之间有一分界线,分界线右上方的元素为非金属元素,分界线左下方的元素为金属元素(H除外),分界线两边的元素一般既有金属性,也有非金属性。
(5).对角线规则:沿周期表中金属与非金属分界线方向对角(左上角与右下角)的两主族元素性质相似,这一规律以第二、三周期元素间尤为明显。
1.几个量的关系
周期数=电子层数
主族序数=最外层电子数=最高正价数
|最高正价|+|负价|=8
4.微粒半径大小比较规律
(1).同周期元素(稀有气体除外)的原子半径随原子核电荷数的递增逐渐减小。
(2).同主族元素的原子半径和离子半径随着原子核电荷数的递增逐渐增大。
(3).电子层结构相同的离子,核电荷数越大,则离子半径越小。
(4).同种元素的微粒半径:阳离子<原子<阴离子。
(5).稀有气体元素的原子半径大于同周期元素原子半径.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com