
18.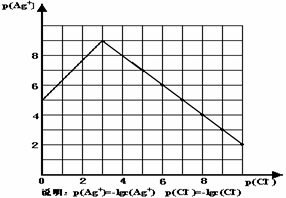 (11分)沉淀物并非绝对不溶,且在水及各种不同的溶液中溶解度有所不同,同离子效应、络合物的形成等都会使沉淀物的溶解度有所改变。已知AgCl + Cl-
==[AgCl2]-, 右图是某温度下AgCl在NaCl溶液中的溶解情况。
(11分)沉淀物并非绝对不溶,且在水及各种不同的溶液中溶解度有所不同,同离子效应、络合物的形成等都会使沉淀物的溶解度有所改变。已知AgCl + Cl-
==[AgCl2]-, 右图是某温度下AgCl在NaCl溶液中的溶解情况。
由以上信息可知:
(1)由图知该温度下AgCl的溶度积常数为 。
(2)AgCl在NaCl溶液中的溶解出现如图所示情况(先变小后变大)的原因是:
(3)设计实验证明S(AgCl)>S(AgI)>S(Ag2S),实验方案是
(4)若在AgCl形成的浊液中滴加氨水有什么现象?
发生反应的离子方程式为 。
17.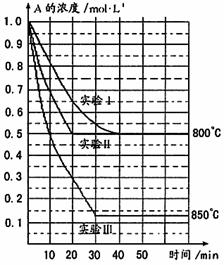 在一恒容密闭容器中发生某化学反应2A(g)
在一恒容密闭容器中发生某化学反应2A(g)  B(g)+C(g),在三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800℃,实验Ⅲ在850℃,B、C的起始浓度都为0,反应物A的浓度(mol·L-1)随时间(min)的变化如图所示:
B(g)+C(g),在三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800℃,实验Ⅲ在850℃,B、C的起始浓度都为0,反应物A的浓度(mol·L-1)随时间(min)的变化如图所示:
试回答下列问题:
(1)在实验Ⅰ中,反应在20 min至40 min内A的平均反应速率为________ __mol·L-1min-1。
(2)实验Ⅱ和实验I相比,可能隐含的反应条件是_____________________________。
(3)根据实验Ⅲ和实验Ⅰ的比较,可推测该反应降低温度,平衡向_____(填“正”或“逆”)反应方向移动,该正反应是_________(填“放热”或“吸热”)反应。
(4)与实验Ⅰ相比,若实验Ⅰ中的A的起始浓度改为0.8 mol·L-1,其它条件不变,则达到平衡时所需用的时间_____ ______实验Ⅰ(填写“大于”、“等于”或“小于”)。
16.污水处理分析时,常用双硫腙(H2Dz,二元弱酸)把金属离子配合成电中性的物质,再用CCl4萃取络合物,从而把金属离子从水溶液中完全分离出来。如用双硫腙(H2Dz)-CCl4分离污水中的Cu2+时,先发生配合反应:Cu2++2 H2Dz Cu(HDz)2+2H+,再加入CCl4,Cu(HDz)2就很容易被萃取到CCl4中。
Cu(HDz)2+2H+,再加入CCl4,Cu(HDz)2就很容易被萃取到CCl4中。
(1)写出双硫腙和Fe3+络合的离子方程式:______________________________。萃取过程中要控制适宜的酸度。如果溶液的pH过大,其后果是______________________________。
下图是用双硫腙(H2Dz)-CCl4络合萃取某些金属离子的酸度曲线。它反映了萃取某些金属离子时适宜的pH范围。E%表示某种金属离子以配合物形式被萃取分离的百分率。
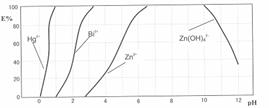
某工业废水中含有Hg2+、Bi3+、Zn2+,用双硫腙(H2Dz)-CCl4络合萃取法处理废水。
请根据上图回答问题:
(2)欲完全将废水中的Hg2+分离出来,须控制溶液pH=____________________。
(3)当调节pH=2时,铋(Bi)的存在形式有:____________________,其物质的量之比为____________________。
(4)萃取到CCl4中的Zn(HDz)2分液后,加入足量的NaOH溶液,充分振荡后,锌又转到水溶液中。写出反应的离子方程式:________________________________________。
探究能力测试发挥你的潜能
15.在2L密闭容器中,800℃时反应2NO(g)+O2(g) 2NO2(g)体系中,n(NO)随时间变化如表:
2NO2(g)体系中,n(NO)随时间变化如表:

(1)写出该反应的平衡常数表达式:K=___________ ________。已知:K(300℃)>K(350℃),该反应是_____ ___热反应。
(2)下图中表示NO2的变化的曲线是________ ____。用O2表示从0-2s内该反应的平均速率v=___。
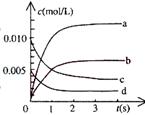 (3)能说明该反应已经达到平衡状态的是___________。
(3)能说明该反应已经达到平衡状态的是___________。
a、v(NO2)=2v(O2) b、容器内压强保持不变
c、v逆(NO)=2v正(O2) d、容器内的密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是__________。
a、及时分离出NO2气体 b、适当升高温度 c、增大O2的浓度 d、选择高效的催化剂
14.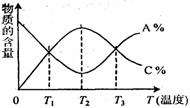
 已知可逆反应aA+bB cC中,物质的含量A%和C%随温度的变化曲线如图所示,下列说法正确的是
已知可逆反应aA+bB cC中,物质的含量A%和C%随温度的变化曲线如图所示,下列说法正确的是
A.该反应在T1、T3温度时达到化学平衡
B.该反应在T2温度时达到化学平衡
C.升高温度,平衡会向正反应方向移动
D.该反应的正反应是放热反应
13.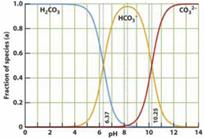 下图是一水溶液在pH从 0至14的范围内,H2CO3、HCO3-、CO32-三种成分平衡时的组成百分率,下列叙述正确的是
下图是一水溶液在pH从 0至14的范围内,H2CO3、HCO3-、CO32-三种成分平衡时的组成百分率,下列叙述正确的是
A.此图可完全根据1.0 mol/LHCl溶液滴定1.0mol/L碳酸钠溶液的实验数据绘出
B.1.0 mol/LHCl溶液滴定1.0mol/L碳酸钠溶液恰好反应时呈中性
C.二氧化碳溶液在血液中多以HCO3-的形式存在
D.在pH为6.37及10.25时,溶液中C(H2CO3)= C(HCO3-)= C(CO32-)
12.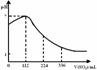 已知:2H2S+SO2=3S↓+2H2O。某同学向100mL氢硫酸溶液中通人标准状况下的二氧化硫气体,所得溶液pH变化如图所示。他据此得到的下列四条关于二氧化硫和亚硫酸的说法。请分析其中正确的是
已知:2H2S+SO2=3S↓+2H2O。某同学向100mL氢硫酸溶液中通人标准状况下的二氧化硫气体,所得溶液pH变化如图所示。他据此得到的下列四条关于二氧化硫和亚硫酸的说法。请分析其中正确的是
A.SO2是弱电解质
B.H2SO3不是强酸
C.亚硫酸是比氢硫酸还弱的酸
D.原氢硫酸溶液的物质的量浓度0.05mol·L-1
11、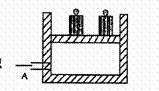 如图所示为一恒压容器。在恒定温度下,将1moIN2和3moIH2混合后由A口快速充入容器,封闭A反应
如图所示为一恒压容器。在恒定温度下,将1moIN2和3moIH2混合后由A口快速充入容器,封闭A反应 ,在t0时刻达到平衡,t2时刻再从A口快速充入一定量NH3,对闭A,
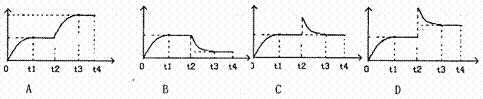
t3重新达平衡至t0。在0--t4时间内混合气中NH3的体积分数(纵坐标)随时间:(横坐标)变化的曲线正确的是 C
,在t0时刻达到平衡,t2时刻再从A口快速充入一定量NH3,对闭A,
t3重新达平衡至t0。在0--t4时间内混合气中NH3的体积分数(纵坐标)随时间:(横坐标)变化的曲线正确的是 C
10.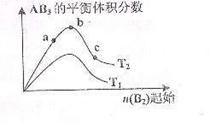 某化学科研小组研究在其他条件不变时,改变某一条件对A2(g)+3B2(g)
某化学科研小组研究在其他条件不变时,改变某一条件对A2(g)+3B2(g)
 2AB3(g)化学平衡状态的影响,得到如下图所示的变化规律(图中T表示温度,n表示物质的量),
2AB3(g)化学平衡状态的影响,得到如下图所示的变化规律(图中T表示温度,n表示物质的量),
根据图示得出的判断结论正确的是
A.反应速率a>b>c
B.达到平衡时A2的转化率大小为:b>a>c
C.若T2>T1,则正反应是放热反应
D.达到平衡时,AB3的物质的量大小为:c>b>a
9、甲、乙两种物质溶解度曲线如右图所示:下列说法一定正确的是
A、A点表示T1℃时甲的溶液已饱和,乙的溶液未饱和
B、B点表示T2℃时甲、乙两物质的溶液均达饱和且两溶液的物质的量浓度相等
C、将T3℃时甲、乙两物质的饱和溶液分别降温至T2℃,析出的乙比析出的甲多
D、若乙中含有少量的甲,可用重结晶的方法提纯乙
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com