
19.(8分)(1)Zn2+4 OH-=[Zn(OH4)]2- (2分) (2)10-17 (2分)
(3)8.0~12.0 (2分) (4)1.80 (2分)
18.(11分)(1) 10-12 (2分)
(2)Cl-抑制了AgCl的溶解,但Cl-浓度增大使AgCl形成络合物:AgCl + Cl- ==[AgCl2]-(2分)
(3)向AgCl悬浊液中滴加KI稀溶液(0.1mol/L),固体由白色转化为黄色,再向悬浊液中滴加同浓度Na2S稀溶液(0.1mol/L),固体由黄色转化为黑色。(3分)
(4)白色沉淀溶解,形成无色溶液(2分);AgCl+2NH3=Ag(NH3)2++ Cl-(2分)
17.(1)0.01 (2分) (2)使用了催化剂 (2分) (3)逆(1分),吸热 (1分)(4)大于 (2分)
16.(1)Fe3++3H2Dz Fe(HDz)3+3H+ (2分) 。Fe3+ 会形成Fe(OH)3沉淀 (2分);(2)1 (1分);(3)Bi3+ Bi(HDz)3 (2分) ;3∶2
(1分);(4)Zn(HDz)2+6OH-=Zn(OH)4-+2Dz2-+2H2O (2分)
Fe(HDz)3+3H+ (2分) 。Fe3+ 会形成Fe(OH)3沉淀 (2分);(2)1 (1分);(3)Bi3+ Bi(HDz)3 (2分) ;3∶2
(1分);(4)Zn(HDz)2+6OH-=Zn(OH)4-+2Dz2-+2H2O (2分)
15.答案:(1)K=;放热。(2)b 1.5×10-3mol/(L·s)。(3)b c。(4)c。
12.[解析]二氧化硫不是电解质,A错;从图上看,在224mL时,0.05 mol·L-1的亚硫酸的pH远小于1,说明它是弱酸,B正确;根据方程式:2H2S+SO2=3S+2H2O得,原氢硫酸溶液的物质的量浓度0.1 mol·L-1,D错;从图中看出,同浓度的亚硫酸比氢硫酸的pH小,则其酸性比氢硫酸的要强,C错。
7.答案:C。解析:此题结合化学平衡图像考查外界条件对化学平衡的影响。根据“先拐先平
数值大”的原则,选项A、B正确;根据升高温度,平衡向吸热反应方向移动(即逆反应方向移
动),可确定A、B正确;根据使用催化剂只能改变化学反应速率,缩短达到平衡的时间,但对
化学平衡的移动无影响,所以选项D正确。
6.D 由曲线斜率可知在某一时间段内NO的消失的速率比RH快;NO的浓度一直在减小,NO2的浓度先升高后减小,在0-1时间段内NO可能生成NO2;O3、PAN的浓度在增加,而RH浓度在减小,RH及NO2在某一时间段内可能生成PAN及O3;O3的浓度一直在增加,不可以生成PAN,D不正确。
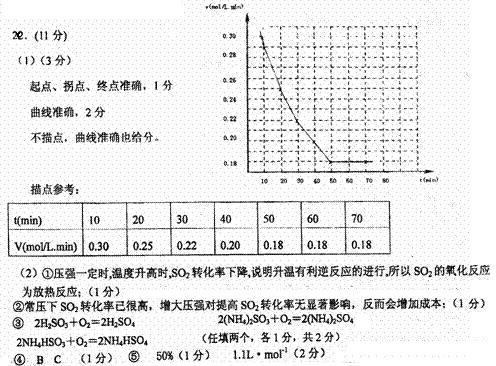
20.(11分)
(1)下表为某温度和压强下,密闭容器中SO2氧化为SO3反应在不同时间各物质的浓度(mol/L)

试画出V(SO3)―t图。
(2)工业上生产硫酸时,利用催化氧化反应将SO2转化为SO3是一个关键步骤。压强及温度对SO2转化率的影响如下表(原料气各成分的体积分数为:SO2:7%,O2:11%,N2:82%):
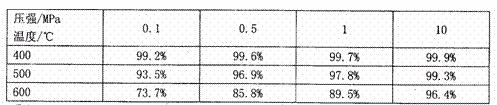
①如何利用表中数据推断SO2的氧化反应的热效应?
②在400一500℃时,SO2的催化氧化采用常压而不是高压,主要原因是:
 ③工业制硫酸所产生的尾气含有SO2、微量的SO3和酸雾。为了保护环境将尾气通入氨水中,
③工业制硫酸所产生的尾气含有SO2、微量的SO3和酸雾。为了保护环境将尾气通入氨水中,
能发生多个反应,写出其中可能发生的两个氧化还原反应的化学方程式:
④能用于测定硫酸尾气中SO2含量的是_ 。(填字母)
A.NaOH溶液、酚酞试液 B.KMnO4溶液、稀H2SO4
C.碘水、淀粉溶液 D.氨水、酚酞试液
⑤某温度下,SO2氧化为SO3在10L的密闭容器中进行,开始向容器加入4.0 mol SO2和10.0mo1O2,当反应达到平衡时,混合气体为13.0 mol,则SO2的转化率为 _,该温度反应的平衡常数
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
|
A |
D |
C |
C |
C |
D |
C |
AB |
D |
D |
C |
B |
C |
BD |
19.(8分)如图:横轴表示溶液的pH,纵轴表示Zn2+离子或[Zn(OH4)]2-。P离子(配离子)物质的量浓度的对数,回答下列问题。
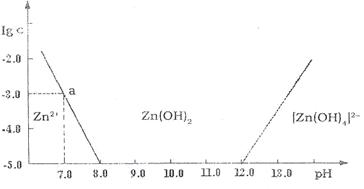
(1)往ZnCl2溶液中加入过量的氢氧化钠溶液,反应的离子方程式可表示为
。
(2)从图中数据计算可得Zn(OH)2的溶度积(Ksp)= 。
(3)某废液中含Zn2+离子,为提取Zn2+。离子可以控制溶液中pH的范围是 。
(4)往1 L 1.00 mol ·L-1 ZnCl2溶液中加入NaOH固体至pH=6,需NaOH mol
(精确到小数点后2位,忽略溶液体积变化)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com