
17.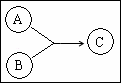 (9分)有机物A、B、C有如图所示转化关系,A的分子式为C3H4O2,A可与Br2的四氯化碳溶液发生加成反应,1 mol A能与1molNaHCO3溶液恰好完全反应。B所含元素种类与A相同,相对分子质量为46,其中碳的质量分数为 。
(9分)有机物A、B、C有如图所示转化关系,A的分子式为C3H4O2,A可与Br2的四氯化碳溶液发生加成反应,1 mol A能与1molNaHCO3溶液恰好完全反应。B所含元素种类与A相同,相对分子质量为46,其中碳的质量分数为 。
16.(9分)为测定碳酸钙纯度(设所含杂质为SiO2),同学们设计了如下两个实验方案:
[方案I]
(1)组装发生并测定生成气体体积的实验装置,并检验气密性;
(2)称取碳酸钙样品W g;
(3)加入过量盐酸;
(4)收集并测定生成的气体体积V mL。
问题I-1:如果称量样品时,砝码底部有一处未被实验者发现的残缺,那么测定的碳酸 钙的纯度会 (填“偏高、偏低、无影响”)。
问题I-2:在方框中画出测定生成的气体体积的装置简图。
[方案II]
(1)称取碳酸钙样品Wg;
(2)在锥形瓶中用C mol/L盐酸V mL(过量)溶解样品;
(3)加入甲基橙作指示剂,再用浓度为C1 mol/L的标准氢氧化钠溶液滴定过量的盐酸,用去氢氧化钠溶液V1毫升。(已知甲基橙的变色范围是pH=3.1~4.4)
问题II-1:未滤去不溶物SiO2,对测定结果是否有影响?(填有或无) ;
理由是 。
问题II-2:碳酸钙纯度表达式 。
[方案评价]
你认为以上两个方案中,最好的方案是 ,
另一个方案不够好的理由是 。
15.(9分)由硫可制得多硫化钠Na2Sx,x的值一般为2~6。当x=2时,多硫化钠称为过硫化钠。
Ⅰ.过硫化钠加入盐酸中有硫沉淀析出,写出该反应的化学方程式 ,该反应的还原产物是 。
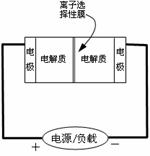 Ⅱ.某些多硫化钠可用于制作蓄电池。下图是一种正在投入生产的大型蓄电系统的原理图。
Ⅱ.某些多硫化钠可用于制作蓄电池。下图是一种正在投入生产的大型蓄电系统的原理图。 电池中的左右两侧为电极,中间为离子选择性膜,在电池放电和充电时该膜只允许钠离子通过。电池充、放电的化学反应方程式为:
电池中的左右两侧为电极,中间为离子选择性膜,在电池放电和充电时该膜只允许钠离子通过。电池充、放电的化学反应方程式为:

|
|
(1)电池中的左侧“电极”的电极名称是 (填
“正极”或“负极”)。
(2)放电过程中钠离子从 (选“左到右”或“右
到左”)通过离子交换膜。
(3)写出充电过程中阳极的电极反应式
。
14.(9分)在容积为2L的密闭容器中,进行反应:A(g)+2B(g)C(g)+D(g)
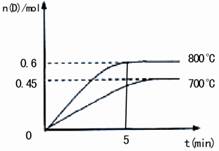 在不同温度下,D的物质的量n(D)和时间t的
在不同温度下,D的物质的量n(D)和时间t的
关系如图所示。试回答下列问题:
(1)800℃时,0-5min内,以B的浓度变化
表示的平均反应速率为 。
(2)能判断该反应达到化学平衡状态的依据
是 。
a.容器中压强不变
b.混合气体中c(A)不变
c.2v正(B)=v逆(D)
d.A、B、C、D四者共存
(3)该反应的正反应为 反应(填吸热或放热);判断的理由是 。
(4)若最初加入1.0molA和2.2molB,利用图中数据计算800℃时的平衡常数K(要求有计算过程)。
13.(8分)有①-⑧八种短周期元素,其原子序数依次增大,其中②、⑦、⑧三种元素在周期表中的相对位置如下,且元素②所处主族的位置为所有主族的正中间。
|
② |
|
|
|
|
|
|
⑦ |
⑧ |
(1)元素②在周期表中的位置为 周期 族;②、⑦、⑧三种元素的原子半径由小到大的顺序是 (用元素符号表示)。②、⑦、⑧三种元素最高价氧化物对应水化物的酸性由强到弱的顺序是 (用化学式表示)。
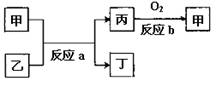 (2)如图所示,甲、乙、丙、丁均为①-⑧中某些
(2)如图所示,甲、乙、丙、丁均为①-⑧中某些
元素形成的单质或化合物,反应a为置换反应,
反应b为化合反应(反应条件已略去),单质
乙与单质丙所含元素位于同一主族,任写一个
符合条件的反应a的化学方程式:
。
12.25℃时,向AgCl的白色悬浊液中依次加入等浓度的KI溶液和Na2S溶液,观察到的现象是先出现黄色沉淀,最后生成黑色沉淀。已知有关物质的颜色和溶度积如下表:
|
物质 |
AgCl |
AgI |
Ag2S |
|
颜色 |
白 |
黄 |
黑 |
|
Ksp(25℃) |
1.8×10-10 |
1.5×10-16 |
1.8×10-50 |
下列叙述中不正确的是 ( )
A.溶度积小的沉淀可以转化为溶度积更小的沉淀
B.若先加入Na2S溶液,再加入KI溶液,则无黄色沉淀产生
C.25℃时,AgC1固体在等体积、等物质的量浓度的NaCl、CaCl2溶液中的溶度积相同
D.25℃时,AgC1固体在等体积、等物质的量浓度的NaCl、CaCl2溶液中的c(Ag+)相同
第Ⅱ卷(64分)
本卷包括必考题和选考题两部分。第13题-第17题为必考题,每个试题考生都必须做答。第18题-第20题为选考题,考生根据要求做答。
11.对于常温下pH为4的醋酸溶液,下列叙述正确的是 ( )
A.该溶液的c(H+)为1×10-4 mol·L-1
B.该溶液lmL稀释至100mL后,pH等于6
C.向该溶液中加入等体积、pH为10的氢氧化钠溶液恰好完全中和
D.该溶液中醋酸电离出的c(H+)与水电离出的c(H+)的比值为106
10.已知HCN的电离常数K=6.2×10-10。用物质的量都是0.1mol的HCN和NaCN混合后配成1L溶液,经测定溶液呈碱性。则下列关系式正确的是 ( )
A.c(CN-)>c(Na+) B.c(CN-)<c(HCN)
C.c(HCN)+ c(CN-)=0.2mol·L-1 D.c(CN-)+ c(OH-)=0.1mol·L-1
9.2008年北京奥运会所用火炬燃料为丙烷,悉尼奥运会所用火炬燃料为65%丁烷和35%丙烷。已知丙烷的燃烧热为:2221.5kJ·mol-1,正丁烷的燃烧热为:2878kJ·mol-1,异丁烷的燃烧热为:2869.6kJ·mol-1。下列有关说法不正确的是 ( )
A.奥运火炬燃烧时的能量转化主要是化学能转变为热能
B.丙烷燃烧的热化学方程式为:C3H8+5O2==3CO2+4H2O △H=-2221.5kJ·mol-1
C.相同物质的量的正丁烷和丙烷分别完全燃烧,前者需要的氧气多,产生的热量也多
D.异丁烷比正丁烷稳定
8.一定量的稀H2SO4 与过量铁粉反应时,为减缓反应速率,且不影响生成H2的总量,可采取的措施是 ( )
A.将铁粉改为铁片
B.向稀H2SO4中加入少量的CuSO4溶液
C.向稀H2SO4中加入少量的CH3COONa固体
D.向稀H2SO4中加入少量的NaOH固体
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com