
2.已知集合 只有一个元素,则a的值为 ( )
只有一个元素,则a的值为 ( )
A.0 B.1 C.0或1 D.-1
1.若复数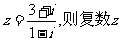 在复平面上的对应点在 ( )
在复平面上的对应点在 ( )
A.第四象限 B.第三象限
C.第二象限 D.第一象限
6.(13分)把煤作为燃料可以通过下列两种途径:
途径I: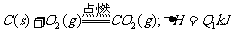
途径II:先制水煤气:

再燃烧水煤气:
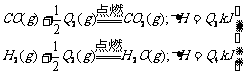
试回答下列问题:
(1)判断两种途径放热:途径I放出的热量______________(填“大于”、“等于”、“小于”)途径II放出的热量。
(2)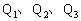 、Q4的数学关系式是_____________________________。
、Q4的数学关系式是_____________________________。
(3)由于制取水煤气反应里,反应物所具有的总能量______________生成物所具有的总能量,那么在化学反应时,反应物应需要______________能量才能转化为生成物,因此其反应条件为______________。
(4)简述煤通过途径II作为燃料的意义。
_________________________________________________________________________________________________________________________________________________。
答案:(1)等于
(2)Q1=Q2+Q3+Q4
(3)低于;吸收;高温
(4)固体煤经处理变为气体燃料后,不仅在燃烧时可以大大减少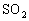 和烟尘对大气造成的污染,而且燃烧效率高,也便于输送
和烟尘对大气造成的污染,而且燃烧效率高,也便于输送
5.已知(1)H2(g) + 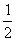 O2(g) = H2O (g) △H1= a kJ·mol-1
O2(g) = H2O (g) △H1= a kJ·mol-1
(2)2H2(g) + O2(g) = 2 H2O (g) △H2= b kJ·mol-1
(3)H2(g) + 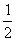 O2(g) = H2O (g) △H3= c kJ·mol-1
O2(g) = H2O (g) △H3= c kJ·mol-1
(4)2H2(g) + O2(g) = 2H2O (g) △H4= d kJ·mol-1
下列关系式正确的是( C )
A.a<c<0 B.b>d>0 C.2a=b<0 D.2c=d>0
4.已知在25℃、101kPa下,1gC8H18(辛烷)燃烧生成二氧化碳和液态水时放出48.40kJ热量。表示上述反应的热化学方程式正确的是 ( B )
A.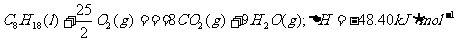
B.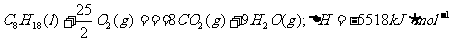
C.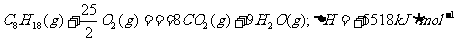
D.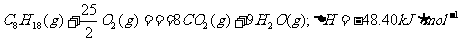
3.实验室用4mol SO2与2mol
O2进行下列反应: 2SO2(g)+O2(g) 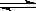 2SO3(g);
2SO3(g);
ΔH=―196.64KJ/mol,当放出314.624KJ热量时,SO2的转化率为 ( A )
A.40% B.50% C.80% D.90%
2.已知:
 ,
,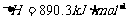
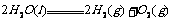 ,
,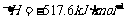 ,则等质量的氢气和甲烷分别燃烧后,放出的热量之比约是( C )
,则等质量的氢气和甲烷分别燃烧后,放出的热量之比约是( C )
A.1:3.4 B.1:1.7 C.2.3:1 D.4.6:1
1.在下列各说法中,正确的是。( B )
A.△H > 0 kJ·mol-1表示放热反应,△H < 0 kJ·mol-1表示吸热反应
B.热化学方程式中的化学计量数表示物质的量,可以是分数
C.1 mol H2SO4与1 mol Ba(OH)2反应生成BaSO4沉淀时放出的热叫做中和热
D.1 mol H2与0.5 molO2反应放出的热就是H2的燃烧热
3.检查△H的数值是否与反应物或生成物的物质的量相匹配(成比例)
注意:⑴要注明反应温度和压强,若反应在298K和1.013×105Pa条件下进行,可不予注明;
⑵要注明反应物和生成物的聚集状态,常用s、l、g分别表示固体、液体和气体;
⑶△H与化学计量系数有关,注意不要弄错。方程式与△H应用分号隔开,一定要写明“+”、“-”数值和单位。计量系数以“mol”为单位,可以是小数或分数。
⑷一定要区别比较“反应热”、“中和热”、“燃烧热”等概念的异同。
针对性练习
2.检查△H的“+”“-”是否与吸热、放热一致。(注意△H的“+”与“-”,放热反应为“-”,吸热反应为“+”)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com