
第一节:单项填空(共15小题,每小题1分,满分15分)
从A、B、C、D四个选项中,选出可以填入空白处的最佳选项,并在答题卡上将该项涂黑。
21.When the spaceship traveled above, new-looking earth appeared before us,
earth that we had never seen before.
A.a; the B.the; an C./; the D.a; an
31.(18分)
I.(7分)血液是人体的一种重要组织,它具有多方面的重要作用。
(1)血浆是内环境的重要组成部分,血浆pH的相对稳定主要依赖于其中的 物质。
(2)血液在体温调节中有重要作用。如人体在运动过程中,产热量大量增加,通过 。的体温调节中枢的调节,使皮肤的血管舒张,血液量增大,也使 增多,散热量增加,从而保持体温的相对稳定。
(3)血液具有防御功能。血液中的白细胞能吞噬分解外来的微生物,这属于 免疫。能导致结构杆菌的宿主细胞裂解死亡的细胞称 。
(4)血液中的葡萄糖是重要的供能物质,维持血糖含量相对稳定的激素主要是
(写出三种)。科学家通过研究发现,把摄取糖与声音刺激多次结合以后,单独的声音刺激就能引起几乎与摄取糖时同时的血糖含量变化,这说明了调节血糖的高级神经中枢是在 。
II.(11分)有机物的运输是一个复杂的生理过程,不仅决定于植物的本性,也受环境条件的影响。有机物在植物体内主要是通过韧皮部以主动运输的方式进行运输的。有机物进入韧皮部后,可向上运输到正在生长的茎枝顶端、嫩叶等部位,也同样可以沿茎部向下运输到根部或地下贮藏器官。请根据下图所示情况回答问题:
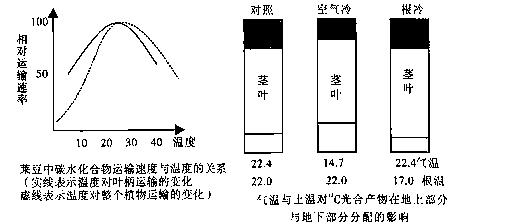
(1)左上图中采用含有14C的14CO2来追踪光合作用中的碳原子的转移途径,这种研究方法称为 ;CO2的碳原子在植物体内的转移途径是CO2→ → 。
(2)从左上图可以看出,有机物运输的最适温度在20℃~30℃。如果高于或低于这个范围,其运输速度会大大降低。究其原因,如果温度过低, ;如果温度太高,由于 ,所以运输速度也降低。
(3)从右上图可以看出,当土温大于气温时,植物的光合产物向 运输的比例较大;当气温高于土温时,则有利于光合产物向 运输。
(4)结合两图可以看出,温度不仅影响有机物运输的 ,也会影响有机物运输的
。
30.(26分)
I.(14分)现有一种常见遗传病,某正常人无致病基因,甲、乙、丙三人均表现正常。这四人的3号和18号染色体上相关基因对应部分的碱基排列顺序如表所示。请分析回答:
|
|
正常人 |
甲 |
乙 |
丙 |
|
3号染色体 |
GAA |
GTA |
GAA |
GTA |
|
18号染色体 |
TAA |
TAA |
CAA |
TAA |
(1)表示所示甲的3号染色体上,该部位碱基排列顺序变为GAT的根本原因是 的结果。
(2)甲、乙、丙三人表现正常的原因可能有:
①突变后的基因为 基因;②突变后的基因 不变。
(3)若表中标明碱基的那条链为非模板链,请写出乙个体第18号染色体上该基因片段转录成的密码子为 。
(4)若甲、乙、丙体内变化的基因均为致病基因,且甲为女性,乙、丙为男性,则甲不宜和 组成家庭,因为他们所生后代患相关遗传病的几率为 。
(5)如果某人3号染色体上的部分基因转移到了18号染色体上,则这种变异类型是 。
II.(12分)为研究细菌的生长,将在含国氨同位素14N的培养基上培养多代的细菌转移到含重氮同位素15N的培养基上繁殖一代,再转移到含14N的培养基上继续生长,繁殖n代。
(1)实验后,含轻氮和重氮同位素的双链DNA比例是
|
只含14N的DNA |
含两种氮的DNA |
只含15N的DNA |
|
|
|
|
(2)在这些细菌中分别有两类[mRNA(A)和mRNA(B)]是从两种不同的基因表达的,已被分离出,两种mRNA含有相同的核苷酸。估算两种mRNA的每一种中的核苷酸的组成(见下表)
|
mRNA |
A% |
C% |
G% |
U% |
|
A |
17 |
28 |
32 |
23 |
|
B |
27 |
13 |
27 |
33 |
则下图中曲线分别代表基因A和基因B编码区的DNA解链曲线。
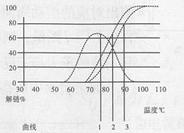 基因A和基因B编码区的DNA的解链曲线分别是
。
基因A和基因B编码区的DNA的解链曲线分别是
。
(3)假设在基因A的某一片段中腺嘌呤脱氧核苷酸的
含量占全部脱氧核苷酸的18%,则在该片断的一
条链上胞嘧啶脱氧核苷酸占该链全部脱氧核苷酸
的比例(x)为 。
(4)上述DNA若在生物体内解开双螺旋结构需要
的条件是 。
29.(10分)根据下面甲、乙、丙三个图解回答有关问题:
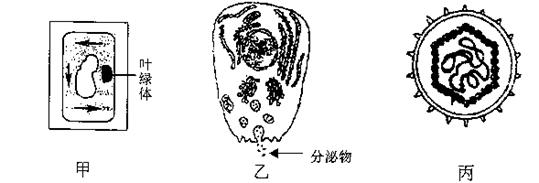
(1)请写出两种鉴定甲细胞是否为活细胞的实验方法:
① ②
(2)已知乙细胞的分泌物是蛋白质类物质。蛋白质类分泌物除可能是酶外,还可能是
(至少写出两种可能的分泌物名称)。若该分泌物是H2O2酶,欲比较该酶与无机催化剂的催化效率,则除需要H2O2酶及必需的实验器具外,还需要哪些实验药品? 。
(3)图丙所示生物常使人及其他生物产生疾病,该类生物与细菌在结构上的主要区别是:
。
28.(11分)某研究性学习小组为探究铜、锌与浓盐酸的反应,设计实验探究方案如下:
实验用品:纯锌片、铜片、37%的浓盐酸、蒸馏水、氯化钾溶液、稀硝酸溶液
实验记录:
|
背影资料:
|
请你参与以下探究:
(1)实验A反应速度明显比B小,原因是 。
(2)根据“铜位于金属活动顺序表氢之后,与稀盐酸不反应,而在实验中加热时又产生气体”的事实,作出如下推断:
①有同学认为“实验C中加热时产生的气体是溶解在溶液中的H2”,你认为是否有道理,理由是 。
②某同学作了如下猜想:是否成立?请你设计实验方案加入验证。
|
猜想 |
验证方法 |
预测现象及结论 |
|
认为铜片中可能含有锌等杂质 |
|
|
(3)某同学对实验D中的白色沉淀进行分析:“不可能是CuCl2,因为CuCl2能溶于水且溶液显蓝色;也不可能是ZnCl2,因为稀释后溶液更稀,不会析出ZnCl2晶体。若利用资源卡片资料大胆猜想,白色沉淀可能是CuCl。请你帮他设计验证方案(若有多处方案,只设计两个)。
|
猜想 |
预计验证方法 |
猜想的现象与结论 |
|
白色沉淀是氯化亚铜 |
|
|
|
|
|
(4)指导老师肯定了实验D中的白色沉淀是CuCl;并措出生成沉淀的原因,实际上是[CuCl4]2等离子与CuCl(s)、Cl三者之间所形成的沉淀溶解平衡移动的结果。请写出这一平衡关系式(用离子方程式表示): 。
26.(14分)CO不仅是家用煤气的主要成分,也是重要的化工原料。美国近年来报导了一种低温低压催化工艺,把某些简单的有机物经“羰化”反应后可以最后产生一类具有优良性能的装饰性高分子涂料、粘合剂等。如下图所示:

图中G(RCOOR,)的一种同分异构体是E的相邻同系物;而H的一种同分异构体则是F的相邻同系物。已知D由CO和H2按物质的量之比为1∶2完全反应而成,其氧化产物可发生银镜反应;H是含有4个碳原子的化合物。试写出:
(1)结构简式:E 、G 、R,基 。
(2)G的两个同类别同分异构体的结构简式(不带R字母) 及 。
(3)反应类型:X 、Y 、Z 。
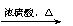
 (4)写出下列转化的化学方程式:
(4)写出下列转化的化学方程式:
① A + CO + H2O E; ②F + D H
① ;
② 。
 27.(14分)高铁酸钾(K2FeO4)是一种集氧化、吸附、
27.(14分)高铁酸钾(K2FeO4)是一种集氧化、吸附、
絮凝、杀菌、灭菌、去浊、脱色、除臭为一体的新
型、高效、绿色环保的多功能水处理剂。近十几年
来,我国对高铁酸钾在饮用水处理中的应用的研究
也不断深入,已取得可喜成果。比较理想的制备方
法是次氯酸盐氧化法:先向KOH溶液中通入足量
Cl2制备次氯酸钾饱和溶液,再分次加入KOH固体,
得到次氯酸钾强碱性饱和溶液,加入三价铁盐,合成高铁酸钾。
(1)向次氯酸钾强碱饱和溶液中加入三价铁盐发生反应的离子方程式:
①Fe3++3OH-=Fe(OH);② 。
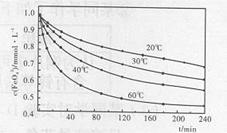
(2)高铁酸钾溶于水能释放大量的原子氧,从而非常有效地杀灭水中的病菌和病毒,与此同时,自身被还原成新生态的Fe(OH)3,这是一种品质优良的无机絮凝剂,能高效地除去水中的微细悬浮物。将适量K2Fe2O4溶液于pH=4.74的溶液中,配制成c(FeO2-4)=1.0mmol·L-1试样,将试样分别置于20℃、30℃、40℃和60℃的恒温水浴中,测定c(FeO+2-4)的变化,结果见下图。高铁酸钾与水反应的离子反应方程式为 ,该反应的△H 0(填“>”“<”或“=”)。
(3)高铁酸盐还是一类环保型高性能电池的材料,用它做成的电池能量高,放电电流大,能长时间保持稳定的放电电压。高铁电池的总反应为:
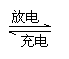
3Zn+2K2FeO4+8H2O 3Zn(OH)3+2Fe(OH)3+4KOH
该电池放电时的负极反应式为 ,若外电路有5.418×1022个电子通过,则正极有 g高铁酸钾参与反应。
(4)测定某K2FeO4溶液浓度的实验步骤如下:
步骤1:准确量取V mL K2FeO4溶液加入到锥形瓶中
步骤2:在强碱性溶液中,用过量CrO-2与FeO2-4反应生成Fe(OH)3和CrO2-4
步骤3:加足量稀硫酸,使CrO2-4转化为Cr2O2-2,CrO-2转化为Cr3+,Fe(OH)3转化为Fe2+
步骤4:加入二苯胺磺酸钠作指示剂,用c mol·L-1(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗(NH4)2Fe(SO4)2溶液V1mL。
①滴定时发生反应的离子方程式为 。
②原溶液中K2FeO4的浓度为 (用含字母的代数式表示)。
25.(19分)已知A、B、C、D、E、F、C、H八种元素位于元素周期表前四个周期。A、B、C是三种非金属元素,A与B的原子的核外电子数之和与C原子的核外电子数相等且A、B、C能形成离子化合物。B与H位于同一主族,D的单质是中学化学常见的两性金属,E的单质是日常生活中用途最广泛的金属且其价电子数是G的两倍,F原子的最外电子层的p电子数是s电子数的两倍,D、H、F位于同一周期且原子序数依次增大,A、C、E、G、H的基态原子中未成对电子数均与其周期序数相同。请用化学用语回答以下问题:
(1)A、B、C形成的此化合物中存在的化学键的类型有 。E单质在常温下遇到A、B、C形成的另一化合物的浓溶液发生钝化现象,过量的E单质在此化合物的稀溶液中发生反应的离子方程式为 ,E的基态电子排布式为 ,E3+与E2+的稳定性大小为 。
(2)B、C、D、H四种元素的第一电离能由大到小的顺序为 ,电负性由小到大的顺序为 。
(3)A、C、G可形成一种相对分子质量为46的一元羧酸分子,其分子中存在的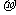 键和
键和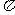 键的数目之比为
;F、G对应的氢化物中键能大小为F-H键
G-H键。
键的数目之比为
;F、G对应的氢化物中键能大小为F-H键
G-H键。
(4)等浓度、等体积的盐酸和氢氧化铀溶液分别与足量的D的单质反应放出的气体在常温常压下的体积比为 ,将所得溶液混合刚含有D元素的两种物质间发生反应的离子方程式为 。
(5)由A、C、F可形成两种酸类化合物,用离了方程式说明它们的酸性强弱 。由A、C、F与钠四种元素按原子个数比为l:3:1:1组成一种化合物,其水溶液硅酸性,则该溶液中各种离子的浓度由大到小的顺序为 ,向该溶液中滴入少量的氢氧化钡济液时发生反应的离子方程式为 。
24.(20分)如图所示,在倾角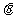 =30°的斜面上放置一段凹槽B,B与斜面间的动摩擦因数
=30°的斜面上放置一段凹槽B,B与斜面间的动摩擦因数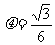 ,槽内靠近右侧壁处有一小球A,它到凹槽内左侧壁的距离
,槽内靠近右侧壁处有一小球A,它到凹槽内左侧壁的距离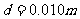 .A、B的质量都为m=2.0kg.B与斜面间的最大静摩擦力可认为等于滑动摩擦力,不计A、B之间的摩擦,斜面足够长。现同刚由静止释放A、B,经过一段时间,A与B的侧壁发生碰撞, 碰撞过程不损失机械能,碰撞时间极短。取重力加速度g=10m/s。2求:
.A、B的质量都为m=2.0kg.B与斜面间的最大静摩擦力可认为等于滑动摩擦力,不计A、B之间的摩擦,斜面足够长。现同刚由静止释放A、B,经过一段时间,A与B的侧壁发生碰撞, 碰撞过程不损失机械能,碰撞时间极短。取重力加速度g=10m/s。2求:
(1)A与B的左侧壁第一次发生碰撞后瞬间A、B的速度。
 (2)在A与B的左侧壁发生第一次碰撞后到第二次碰撞前的这段时间内,A与B的左侧壁的距离最大可达到多少?
(2)在A与B的左侧壁发生第一次碰撞后到第二次碰撞前的这段时间内,A与B的左侧壁的距离最大可达到多少?
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com