
3.电离度:
弱电解质在水中的电离达到平衡状态时,已电离的溶质的分子数占原有溶质分子总数的百分率,称为电离度。常用α表示:
α=
2.电离平衡常数:
在一定条件下达到电离平衡时,弱电解质电离形成的各种离子的浓度的乘积与溶液中未电离的分子的浓度之比是一个常数,这个常数称为电离平衡常数,简称电离常数。
[注意]
(1)电离常数服从化学平衡常数的一般规律,只受温度影响,与溶液的浓度无关。温度一定时,弱电解质具有确定的电离常数值。
(2)电离常数越大,达到平衡时弱电解质电离出的离子越多,电解质电离程度越大。
(3)多元弱酸的电离是分步进行的,每一步电离都有各自的电离常数,每一步电离程度各不相同,差异较大,且逐级减小,故以第一步电离为主,氢离子主要由第一步电离产生。
强电解质在溶液中完全电离,不存在电离平衡。弱电解质在溶液中电离时,不完全电离,存在电离平衡。当弱电解质的离子化速率和分子化速率相等时,则建立了电离平衡。其平衡特点与化学平衡相似。(动、定、变)
1.电离方程式:
书写强电解质的电离方程式时常用“=”,书写弱电解质的电离方程式时常用“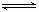 ”。
”。
5.强、弱电解质在熔融态的导电性:
离子型的强电解质由离子构成,在熔融态时产生自由移动的离子,可以导电。而共价型的强电解质以及弱电解质由分子构成,熔融态时仍以分子形式存在,所以不导电。
4.强、弱电解质与物质结构的关系:
强电解质一般为离子化合物和一些含强极性键的共价化合物,弱电解质一般为含弱极性键的化合物。
3.强、弱电解质与溶液导电性的关系:
溶液的导电性强弱与溶液中的离子浓度大小有关。强电解质溶液的导电性不一定强,如很稀的强电解质溶液,其离子浓度很小,导电性很弱。而弱电解质溶液的导电性不一定弱,如较浓的弱电解质溶液,其电离出的离子浓度可以较大,导电性可以较强。
2.强、弱电解质与溶解性的关系:
电解质的强弱取决于电解质在水溶液中是否完全电离,与溶解度的大小无关。一些难溶的电解质,但溶解的部分能全部电离,则仍属强电解质。如:BaSO4、BaCO3等。
强电解质:在溶液中能够全部电离的电解质。则强电解质溶液中不存在电离平衡。
弱电解质:在溶液中只是部分电离的电解质。则弱电解质溶液中存在电离平衡。
[注意]
1.强、弱电解质的范围:
强电解质:强酸、强碱、绝大多数盐
弱电解质:弱酸、弱碱、水
4.溶剂化作用:电解质溶于水后形成的离子或分子并不是单独存在的,而是与水分子相互吸引、相互结合,以“水合离子”或“水合分子”的形态存在,这种溶质分子或离子与溶剂相互吸引的作用叫做溶剂作用。
3.常见电解质的范围:酸、碱、盐、离子型氧化物。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com