
5. pH=13的强碱溶液与pH=2的强酸溶液混合,所得混合液的pH=11,则强碱与强酸的体积比是
A. 11:1 B. 9:1 C. 1:9 D. 1:11
4.已达电离平衡的0.1mol/L的醋酸溶液中,为提高醋酸的电离程度,同时使溶液的pH值降低,应采取的措施是
A. 加一定量水 B.加热 C. 加入盐酸 D. 加入冰醋酸
3.25℃时,在0.01mol/L的稀硫酸中,水电离出的[H+]是
A. 5×10-13mol/L B. 0.02mol/L C. 1×10-7mol/L D. 1×10-12mol/L
2. 有甲乙两种溶液,甲溶液的pH是乙溶液的两倍,则甲溶液中的[H+]与乙溶液中的[H+]的关系是
A. 2∶1 B. 100∶1 C. 1∶100 D. 无法确定
1.下列说法正确的是
A. 纯水的pH值一定等于7
B. [H+]大于10-7mol/L的溶液一定是酸性溶液
C. pH=2的溶液中[H+]是pH=1的溶液的两倍
D. [H+]=2×10-7mol/L的溶液可能是中性溶液
4.酸混合、碱混合、酸碱混合的溶液pH计算:
①酸混合:直接算 [ H+],再求pH 。
②碱混合:先算[ OH-]后转化为[ H+],再求pH 。
③酸碱混合:要先看谁过量,若酸过量,求 [H+],再求pH;若碱过量,先求[ OH-],再转化为[ H+],最后求pH 。
[H+]混
= 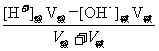
[OH-]混 = 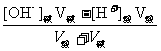
|

[例1](2010全国卷1)下列叙述正确的是
A.在醋酸溶液的 ,将此溶液稀释1倍后,溶液的
,将此溶液稀释1倍后,溶液的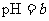 ,则
,则
B.在滴有酚酞溶液的氨水里,加入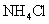 至溶液恰好无色,则此时溶液的
至溶液恰好无色,则此时溶液的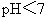
C.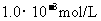 盐酸的
盐酸的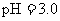 ,
,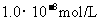 盐酸的
盐酸的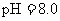
D.若1mL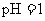 的盐酸与100mL
的盐酸与100mL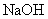 溶液混合后,溶液的
溶液混合后,溶液的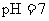 则
则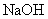 溶液的
溶液的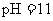
[解析]A若是稀醋酸溶液稀释则C(H+)减小,pH增大,b>a,故A错误;B酚酞的变色范围是pH= 8.0-10.0(无色→红色),现在使红色褪去,pH不一定小于7,可能在7~8之间,故B错误;C常温下酸的pH不可能大于7,只能无限的接近7;D正确,直接代入计算可得是正确,也可用更一般的式子:设强酸pH=a,体积为V1;强碱的pH=b,体积为V2,则有10-aV1=10-(14-b)V2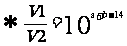 ,现在V1/V2=10-2,又知a=1,所以b=11
,现在V1/V2=10-2,又知a=1,所以b=11
[答案]D
[命题意图]考查弱电解质的稀释,强酸的无限稀释,指示剂的变色范围,强酸与强碱的混合pH的计算等基本概念
[点评]本题在第一轮复习至第三轮复习无时不在强调的基本问题考查就是第二册第三章的问题,这次居然没有考离子浓度大小比较,而考这些,很简单,大家都喜欢!
[例2](2010天津卷,4)
下列液体均处于25℃,有关叙述正确的是
A.某物质的溶液pH < 7,则该物质一定是酸或强酸弱碱盐
B.pH = 4.5的番茄汁中c(H+)是pH = 6.5的牛奶中c(H+)的100倍
C.AgCl在同浓度的CaCl2和NaCl溶液中的溶解度相同
D.pH = 5.6的CH3COOH与CH3COONa混合溶液中,c(Na+) > c(CH3COO-)
解析:某些强酸的酸式盐pH<7,如NaHSO4,故A错;pH=4.5,c(H+)=10-4.5 mol·L-1,pH=6.5,其c(H+)=10-6.5 mol·L-1,故B正确;同浓度的CaCl2溶液的c(Cl-)是NaCl的两倍,它们对AgCl沉淀溶解平衡的抑制程度不同,故C错;混合溶液显酸性,则c(H+)>c(OH-),根据电荷守恒,c(CH3COO-)>c(Na+),故D错。
答案:B
命题立意:综合考查了电解质溶液中的有关知识,包括盐类的水解、溶液的pH与c(H+)的关系、沉淀溶解平衡的移动和溶液中离子浓度大小的比较。
弱电解质的电离 电离平衡单元测试
3.溶液的酸碱性和pH的关系
⑴ pH的计算: pH=-lg[H+]
⑵酸碱性和pH的关系:
在室温下,中性溶液:[H+]=[OH-]=1.0×10-7 mol· L-1, pH =7
酸性溶液: [H+]>[OH-] , [H+]>1.0×10-7 mol·L-1, pH <7
碱性溶液: [H+]<[OH-] , [H+]<1.0×10-7 mol·L-1, pH >7
⑶pH的测定方法:
①酸碱指示剂:粗略地测溶液pH范围
②pH试纸:精略地测定溶液酸碱性强弱
③pH计: 精确地测定溶液酸碱性强弱
2. 影响水的电离平衡的因素
⑴酸和碱:酸或碱的加入都会电离出 H+或OH-,均使水的电离逆向移动,从而抑制水的电离。
⑵温度:由于水的电离吸热,若升高温度,将促进水的电离, [H+]与[OH-]同时同等程度的增加,pH变小,但[ H+]与[OH-]始终相等,故仍呈中性。
⑶能水解的盐:不管水解后溶液呈什么性,均促进水的电离,使水的电离程度增大。
⑷其它因素:如向水中加入活泼金属,由于活泼金属与水电离出来的 H+直接作用,使[ H+]减少,因而促进了水的电离平衡正向移动。
1. 水的电离及离子积常数
⑴水的电离平衡:水是极弱的电解质,能发生自电离:
H2O2+H2O2
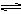 H3O++HO2- 简写为 H2O
H3O++HO2- 简写为 H2O 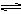 H++OH- (正反应为吸热反应)其电离平衡常数:Ka =
H++OH- (正反应为吸热反应)其电离平衡常数:Ka =
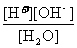
⑵水的离子积常数:Kw=[H+][OH-]
250C 时Kw =1.0×10-14 mol2·L-2 ,水的离子积与温度有关,温度升高Kw增大。如1000C 时Kw =1.0×10-12 mol2·L-2 .
⑶无论是纯水还是酸、碱,盐等电解质的稀溶液,水的离子积为该温度下的Kw。
4.影响电离平衡的因素:
内因:弱电解质的电离程度大小主要由电解质本身的性质决定。
外因:
(1)温度:电离过程热效应小,温度变化不大时可不考虑其影响。电离过程焓值增加(吸热),升高温度,电离程度增大。
(2)浓度:溶液越稀,离子相互碰撞结合成分子的机会越小,弱电解质的电离程度就越大。因此,稀释溶液会促使弱电解质的电离平衡向电离的方向移动。
|

[例1]下列物质的水溶液都能导电,但属于非电解质的是
A、CH3COOH B、Cl2 C、NH4HCO3 D、SO2
[解析]注意氯气为单质,所以既不是电解质也不是非电解质。答案为D。
[例2]下列说法下列正确的是
A、强电解质的水溶液中不存在溶质分子,弱电解质的水溶液中存在溶质分子和离子
B、强电解质的水溶液导电性强于弱电解质的水溶液
C、强电解质都是离子化合物,弱电解质都是共价化合物
D、强电解质易溶于水,弱电解质难溶于水
[解析]强电解质溶于水后,全部电离,不存在溶质分子,而弱电解质溶于水后,只部分电离,存在电离平衡,水溶液中存在溶质分子和离子,故A正确。溶液的导电性是由溶液中的离子浓度大小及离子所带的电荷所决定的,若强电解质溶液是稀溶液,则溶液中离子浓度很小,导电性就很弱,故B不正确。强电解质部分是离子化合物,部分是共价化合物,如H2SO4是强酸,也是强电解质,但属于共价化合物,故C不正确。强电解质与溶解性大小无关,如BaSO4难溶于水,但属于强电解质,而NH3·H2O易溶于水,但属于弱电解质。答案为A
[例3]已知HClO是比H2CO3还弱的酸,氯水中存在下列平衡:Cl2+H2O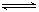 HCl+HClO,HClO
HCl+HClO,HClO 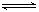 H++ClO—
,达平衡后,要使HClO浓度增加,可加入
H++ClO—
,达平衡后,要使HClO浓度增加,可加入
A、H2S B、CaCO3 C、HCl D、NaOH
[解析]对于A选项,由于H2S与HClO能发生氧化还原反应,因而会使次氯酸的浓度减小。CaCO3能与HCl反应而使Cl2+H2O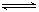 HCl+HClO的平衡正移,使HClO的浓度增加,同时还要注意,因HClO是比H2CO3还弱的酸,所以CaCO3不能与
HCl+HClO的平衡正移,使HClO的浓度增加,同时还要注意,因HClO是比H2CO3还弱的酸,所以CaCO3不能与
 HClO H++ClO—
电离的H+结合,因此不会使次氯酸的浓度因平衡正移而减小。故应选B。对于D,NaOH与H+中和,因而可使两个都正向移动,结果会使HClO浓度减小。
HClO H++ClO—
电离的H+结合,因此不会使次氯酸的浓度因平衡正移而减小。故应选B。对于D,NaOH与H+中和,因而可使两个都正向移动,结果会使HClO浓度减小。
|

第2课时 水的电离和溶液的 pH
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com