
27.(20分)有关元素A、B、C、D、E、F的信息如下:
|
元 素 |
有关信息 |
|
A |
最高价氧化物对应的水化物(甲)能与其气态氢化物(乙)反应生成盐 |
|
B |
最外层电子数是次外层电子数的2倍 |
|
C |
M层上有3个电子 |
|
D |
短周期原子半径最大的主族元素 |
|
E |
其单质是淡黄色固体 |
|
F |
最高正价与最低负价代数和为6 |
请回答下列问题:
 (1)写出实验室制取乙的化学方程式
(1)写出实验室制取乙的化学方程式
(2)下列说法正确的是 (填序号)。
① 实验室可用右图所示装置制取B的最高价氧化物
② 用C单质做成的槽车,都可用来运输甲的浓溶液
③ C和铜与稀硫酸组成的原电池,C电极被还原
④ D单质在空气中燃烧后的产物可用在防毒面具中。
 ⑤鼓励乘坐公交车出行,倡导低碳生活,是控制和治理BO2解决“温室效应”的有效途径之一
⑤鼓励乘坐公交车出行,倡导低碳生活,是控制和治理BO2解决“温室效应”的有效途径之一
⑥DF的电子式为
(3)将E的常见氧化物(该氧化物能使品红溶液褪色)通入由CuSO4和NaCl混合的浓溶液中,溶液颜色变浅,析出白色沉淀,取该沉淀进行元素质量分数分析,知其中含Cl:35.7%,Cu:64.3%,则该氧化物在上述反应中的作用是
A.漂白剂 B.氧化剂 C.还原剂
(4) 已知:2AO2(g) 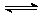 A2O4(g);△H<0。在恒温恒容条件下,将一定量AO2和A2O4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如下图所示。
A2O4(g);△H<0。在恒温恒容条件下,将一定量AO2和A2O4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如下图所示。
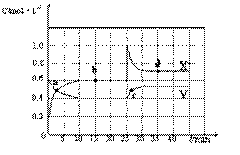
①a、b、c、d四个点中,表示化学反应处于平衡状态的点是 。
②前10 min内用AO2表示的化学反应速率v(AO2)= mol·L-1·min-1。反应在第一个平衡点的平衡常数K(1)= (可用分数表示)。反应在第二个平衡点的平衡常数K(2)与第一个平衡点的平衡常数K(1)的关系:K(2) K(1)(填“>”、“=”或“<”)。
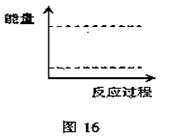
③请在图16坐标中画出1 mol A2O4通入2L的密闭容器中反应发生过程中的能量变化示意图,并在虚线上分别标出反应物和生成物的化学式。
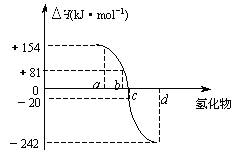 (5)右图中a、b、c、d分别代表氧族元素(ⅥA族)Te(碲) 、Se(硒)、E、O(氧)氢化物的反应热的数据示意图。试回答下列问题:
⑵请你归纳:非金属元素氢化物的稳定性与氢化物的反应热△H的关系_________________。
⑶写出硒化氢在热力学标准态下,发生分解反应的热化学反应方程式:_______
____。
(5)右图中a、b、c、d分别代表氧族元素(ⅥA族)Te(碲) 、Se(硒)、E、O(氧)氢化物的反应热的数据示意图。试回答下列问题:
⑵请你归纳:非金属元素氢化物的稳定性与氢化物的反应热△H的关系_________________。
⑶写出硒化氢在热力学标准态下,发生分解反应的热化学反应方程式:_______
____。
26.(12分)硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量。实验步骤如下:
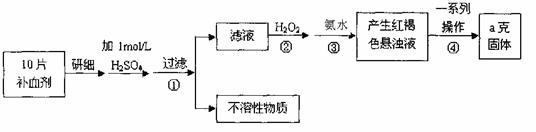
请回答下列问题:
(1)证明步骤①滤液中含有Fe2+的方法是 。
(2)步骤②加入过量H2O2的目的: 。
(3)步骤③中反应的离子方程式: 。
(4)步骤④中一系列处理的操作步骤:过滤、 、灼烧、 、称量。
(5)该小组有些同学认为用KMnO4溶液滴定也能进行铁元素含量的测定。
(5Fe2++MnO4-+8H+→5Fe3++Mn2++4H2O)
① 实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除药匙、天平(附砝码)、玻棒、烧杯、胶头滴管外,还需 。
②滴定到终点时的颜色为 色。
(6)正常人每天应补充14mg左右的铁。其中绝大部分来自于食物。如果全部通过服用含FeSO4·7H2O的片剂。来补充铁,则正常人每天服需用含 mgFeSO4·7H2O片剂。
25.(14分)已知一定条件下,烯烃可发生下列反应:
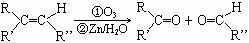
现有如下转化关系,其中A是蜂王浆中的有效成分,分子式为C10H18O3,具有酸性。B能被NaOH溶液中和。C中没有支链,也不含-CH3。G是六元环状化合物,分子式为C4H4O4。
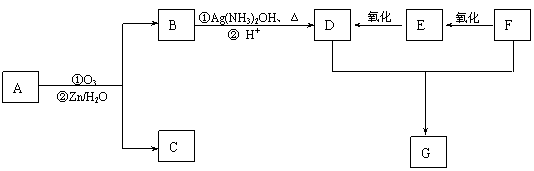
请回答:
(1)E中的官能团名称为 。
(2)在有铜存在时F与氧气反应的化学方程式为
(3)D与F反应生成G的化学方程式为 ;
(4)分子中有2个羧基、且能使Br2的CCl4溶液褪色的G的同分异构体有
(写结构简式)。
(5)A的加聚产物是一种功能高分子材料,该加聚物的结构简式为 。
(6)H是人类所需的营养物质之一,与C有相同的官能团,分子中无支链,质谱显示相对分子质量180,核磁共振氢谱显示有11种峰,结构中每个碳上都连有官能团。18g H完全燃烧生成26.4 gCO2和10.8 g H2O。
写出H与新制Cu(OH)2反应的化学方程式(假定-OH不与Cu(OH)2反应)
12.已知CuSO4溶液分别与Na2CO3溶液、Na2S溶液的反应情况如下:
(1) CuSO4 +Na2CO3 主要: Cu2+ + CO32─ + H2O = Cu(OH)2↓ + CO2↑
次要:Cu2+ + CO32─= CuCO3↓(几乎不发生反应。下同)
(2) CuSO4 +Na2S 主要: Cu2+ + S2─ = CuS↓
次要: Cu2+ + S2─ + 2H2O = Cu(OH)2↓ + H2S↑
则下列几种物质的溶解度大小的比较中,正确的是
A.CuS <Cu(OH)2<CuCO3 B.CuS >Cu(OH)2>CuCO3
C.Cu(OH)2>CuCO3>CuS D.Cu(OH)2<CuCO3<CuS
第Ⅱ卷
11.以水为溶剂进行中和滴定的原理是:H3O++OH--→2H2O。已知液态SO2和纯水的导电性相近,因为液态SO2也会发生自离解:SO2(l)+ SO2(l)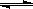 SO32-+SO2+。若以液态SO2为溶剂,用SOCl2滴定Cs2SO3,则以下叙述错误的是
A.该滴定反应可以表示为:SO32-
+ SO2+ → 2SO2
B.在一定温度下,液态SO2中c(SO32-)与c(SO2+)的乘积是一个常数
C.自离解的存在,说明SO2是离子化合物
D.可通过导电能力变化来判断是否到达滴定终点
SO32-+SO2+。若以液态SO2为溶剂,用SOCl2滴定Cs2SO3,则以下叙述错误的是
A.该滴定反应可以表示为:SO32-
+ SO2+ → 2SO2
B.在一定温度下,液态SO2中c(SO32-)与c(SO2+)的乘积是一个常数
C.自离解的存在,说明SO2是离子化合物
D.可通过导电能力变化来判断是否到达滴定终点
10.根据下列实验内容得出的结论正确的是
|
选项 |
实验内容 |
结论 |
|
A |
某物质的水溶液能使红色石蕊试纸变蓝 |
该物质一定是氨气 |
|
B |
某物质的水溶液中加入盐酸产生无色无气味气体 |
该溶液一定含有大量碳酸根离子 |
|
C |
测定同浓度的Na2CO3 和Na2SO4
溶液pH,前者大于后者 |
碳元素非金属性弱于硫 |
|
D |
向沸水中逐滴加入1-2mL FeCl3饱和溶液,搅拌并继续煮沸出现浑浊 |
制备Fe(OH)3胶体 |
9.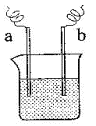 右图中,两电极上发生的电极反应为:
a极:Cu2++2e-=Cu b极:Fe-2e-=Fe2+
下列说法不正确的是
A.装置中电解质溶液一定含有Cu2+
B.该装置一定是化学能转化为电能
C.a、b可能是同种电极材料
D.a极上一定发生还原反应
右图中,两电极上发生的电极反应为:
a极:Cu2++2e-=Cu b极:Fe-2e-=Fe2+
下列说法不正确的是
A.装置中电解质溶液一定含有Cu2+
B.该装置一定是化学能转化为电能
C.a、b可能是同种电极材料
D.a极上一定发生还原反应
1.0×10-amol·L-1和是1.0×10-bmol·L-1,在此温度时,水的离子积为1.0×10-(b+a)
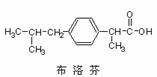
8.下列叙述正确的是
A.布洛芬结构中的氢原子若被氯原子取代,其一氯
代物都只有2种
B.已知反应mX(g)+nY(g)
 qZ(g)
,若平衡时X、 Y的转化率相等,说明反应开始时X、Y的物质的量之比为1:1
qZ(g)
,若平衡时X、 Y的转化率相等,说明反应开始时X、Y的物质的量之比为1:1
C.1 L 1 mol/L Na2CO3溶液中含有3×6.02×1023个离子
D.在一定温度下,相同pH的硫酸和硫酸铁溶液中水电离出来的c(H+)分别是
7.下列说法正确的是
A.K+ 、Cr2O72-、NO3-、Cl- 大量共存的溶液,一定是无色溶液
B.活化能越大的化学反应,其反应热不一定越大 C.因为NH4Cl是强电解质,所以在其水溶液中只存在水解平衡,不存在电离平衡
 D.CH3COOH与NaOH溶液恰好完全反应时,c(CH3COO-)
= c(Na+)
D.CH3COOH与NaOH溶液恰好完全反应时,c(CH3COO-)
= c(Na+)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com