
27. I、在10 ℃和2×105
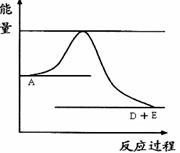
Pa的条件下,反应aA(g) 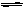 dD(g)+eE(g)建立平衡后,再逐步增大体系的压强(温度维持不变)。下表列出了不同压强下反应建立平衡时物质D的浓度。
dD(g)+eE(g)建立平衡后,再逐步增大体系的压强(温度维持不变)。下表列出了不同压强下反应建立平衡时物质D的浓度。
|
压强/Pa |
2×105 |
5×105 |
1×106 |
|
D的浓度/mol·L-1 |
0.085 |
0.20 |
0.44 |
 右图表示在10 ℃和2×105
Pa下,该反应进行过程中能量(单位为kJ·mol-1)的变化。
右图表示在10 ℃和2×105
Pa下,该反应进行过程中能量(单位为kJ·mol-1)的变化。
根据以上数据,回答下列问题:
(1)在10 ℃和2×105 Pa时,该反应的△H_______0,(填“>”“ <”)。
(2)压强从2×105 Pa增加到5×105 Pa时,平衡向_________(填“正”“逆”)反应方向移动,理由是___________________________。
(3)压强从5×105 Pa增加到1×106 Pa时,平衡向_______(填“正”“逆”)反应方向移动,理由是______。平衡之所以向该反应方向移动,是由于__________________。
Ⅱ.在温度t℃下,某NaOH的稀溶液中c(H+)=10-amol/L,c(OH-)=10-bmol/L,已知a+b=12 该温度下水的离子积Kw=_______;t______25℃(填“大于”、“小于”或“等于”)。向该溶液中逐滴加入pH=c的盐酸(t℃),测得混合溶液的部分pH如下表所示。
|
序号 |
NaOH溶液的体积/mL |
盐酸的体积/mL |
溶液的pH |
|
① |
20.00 |
0.00 |
8 |
|
② |
20.00 |
20.00 |
6 |
假设溶液混合前后的体积变化忽略不计,则c为_______ 。
26.(1)有A、B、C、D、E五种微粒,它们都含有10个电子。通常状况下,微粒A和B为分子,C和E为阳离子,D为阴离子;B溶于A后所得的物质可电离出C和D;A、B、E三种微粒反应后可得C和一种白色沉淀。请回答:
①用化学符号填空:B的结构式 ,C的电子式 。
②写出A、B、E三种微粒反应的离子方程式:
。
(2)甲、乙、丙、丁为前三周期元素形成的微粒,它们的电子总数相等。已知甲、乙、丙为双原子分子或负二价双原子阴离子,丁为原子。
①丙为钙离子组成的离子化合物跟水反应产生一种可燃性气体,该反应的化学方程式为: 。
②乙在高温时是一种还原剂,请用化学方程式表示它在工业上的一种重要用途: 。
③在一定条件下,甲与 反应的化学方程式是
。
反应的化学方程式是
。
④丁的元素符号是 ,它的原子结构示意图为 。
⑤单质丁的晶体熔点比金刚石的熔点 (填“高”或“低”)。
13.近几年一种新型的甜味剂---木糖醇悄悄的走进人们的生活,因为木糖醇是一种理想的蔗糖代替品,它具有甜味足、溶解性好、防龋齿、适合糖尿病患者等优点。木糖醇是一种白色粉末状的固体,结构简式为:CH2OH(CHOH)3CH2OH,
下列有关木糖醇的叙述错误的是:
A、木糖醇与葡萄糖、果糖等一样是一种单糖 B、木糖醇能与水以任意比互溶
C、木糖醇是一种五元醇 D、木糖醇是一种无糖型植物甜味剂
12.下列叙述不正确的是( )
A.相同条件下,向100mL pH=1的硫酸、醋酸、盐酸溶液中分别加入0.46g Na,产生氢气的体积分数为V1、V2、V3,则V1=V2=V3
B.在0.1mol/L某二元弱酸强碱盐NaHA溶液中,c(Na+)=2c(A2-)+c(HA-)+c(H2A)
C.CH3COOH和CH3COONa的混合溶液中,若c(CH3COO-)大于c(Na+),则溶液显酸性
D.10mL 0.02mol/L HCl溶液与10mL 0.01mol/L Ba(OH)2溶液充分混合,若混合后溶液的体积为20mL,则溶液的pH=7
11.下列各选项中有关叙述正确的是( )
A.实验室制取乙酸乙酯时加入试剂的顺序是先加入浓硫酸,然后边摇动试管边慢慢加入乙醇,再加冰醋酸。
B.用铜片、银片、Cu (NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼脂-KNO3的U型管)构成一个原电池。该原电池的正极反应为:Ag++e-=Ag,在外电路中,电流由铜电极流向银电极。
C.常温下将稀NaOH溶液和稀CH3COOH溶液混合,pH=11时,二者恰好完全反应。
D.用石墨电极电解CuSO4溶液,电解过程中溶液的pH不断减小。
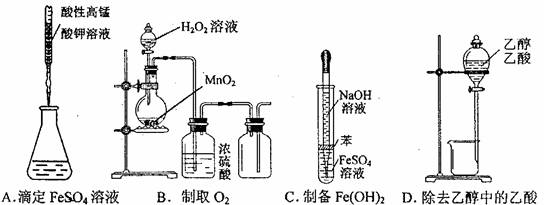
10.下图所示对实验选用或实验操作正确的是( )
9.下列物质与其用途相符合的是
① Cl2-做消毒剂 ② AgBr-制胶卷,感光纸 ③ AgI-人工降雨
④ 碘-预防甲状腺肿大 ⑤ 淀粉-检验I2的存在 ⑥ NaClO-漂白纺织物
A.②③④⑤⑥ B.①②③④⑤ C.②③④⑤ D.全部
8.高温下,某反应达平衡,平衡常数K=。恒容时,温度升高,H2 浓度减小。下列说法正确的是
A.该反应的焓变为正值
B.恒温恒容下,增大压强,H2浓度一定减小
C.升高温度,逆反应速率减小
D.该反应化学方程式为CO + H2催化剂高温 CO2 + H2
7、下列有关乙醇的物理性质的应用中不正确的是( )
A.由于乙醇的密度比水小,所以乙醇中的水可以通过分液的方法除去
B.由于乙醇能够溶解很多有机物和无机物,所以可用乙醇提取中药的有效成分
C.由于乙醇能够以任意比溶解于水,所以酒厂可以勾兑各种浓度的酒
D.由于乙醇容易挥发,所以才有熟语“酒香不怕巷子深”的说法
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com