
23、下列物质中微粒的个数比不是1 : 1的是
A.NaHCO3晶体中的阴离子和阳离子 B.Na2O2固体中的阴离子和阳离子
C.重氢原子中的质子和中子 D.NH3分子中的质子和电子
22、下列是一些化学键的键能。
|
化学键 |
C-H |
C-F |
H-F |
F-F |
键能/(kJ·mol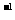 ) ) |
414 |
489 |
565 |
155 |
根据键能数据估算CH4 (g)+4F2 (g) =CF4(g) +4HF(g) 的反应热ΔH为:
A.–1940 kJ · mol-1 B.1940 kJ · mol-1 C.–485 kJ · mol-1 D.485 kJ · mol-1
21、下列事实与氢键有关的是
A.水加热到很高的温度都难以分解
B.水结成冰体积膨胀
C.CH4、SiH4、GeH4、SnH4熔点随相对分子质量增大而升高
D.HF、HCl、HBr、HI的热稳定性依次减弱
20、下列叙述正确的是
A.离子晶体中只存在离子键
B.在CS2、PCl3分子中各原子最外层均达到8电子的稳定结构
C.由同种元素组成的物质一定是纯净物
D.干冰升华时,分子内共价键会发生断裂
19、按电子排布,可把周期表里的元素划分成5个区,以下元素属于p区的是
A.Fe B.Mg C. P D.Cu
18、下列说法中错误的是:
A.SO2、SO3都是极性分子
B.在NH4+ 和[Cu(NH3)4]2+中都存在配位键
C.元素电负性越大的原子,对键合电子的吸引能力越强
D.离子晶体具有熔点较高、硬度较大等特点
17、门捷列夫在描述元素周期表时,许多元素尚未发现,但他为第四周期的三种元素留下了空位,并对它们的一些性质做了预测,X是其中的一种“类硅”元素,后来被德国化学家文克勒发现,并证实门捷列夫当时的预测相当准确。根据元素周期律,下列有关X性质的描述中一定错误的是:
A.X单质不易与水反应 B.XO2可被碳还原为X
C.XCl4的沸点比SiCl4的高 D.XH4的稳定性比SiH4的高
16、钛(22Ti)金属常被称为未来钢铁。钛有46Ti、47Ti、48Ti、49Ti、50Ti等同位素,下列关于金属钛的叙述中不正确的是
A.以上五种钛原子中,中子数不可能为22 B.钛元素在周期表中处于第四周期
C.钛的不同同位素在周期表中处于不同的位置 D.钛元素是属于d区的过渡元素
15、下列不是元素的电负性应用的是
A.判断一种元素是金属还是非金属 B.判断化合物中元素化合价正负
C.判断化学键类型 D.判断化合物溶解性
14、下列各组中的X和Y两种原子,化学性质一定相似的是
A.X原子和Y原子最外层都只有一个电子
B.X原子的核外电子排布为1s2,Y原子的核外电子排布为1s22s2
C.X原子2p能级上有三个电子,Y原子的3p能级上有三个电子
D.X原子核外M层上仅有两个电子,Y原子核外N层上仅有两个电子
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com