
3.2010年1 月 11 日 , 中共中央、国务院在北京隆重举行国家科学技术奖励大会。获得2009年度国家最高科学技术奖的中国科学院院士分别是( )
A.谷超豪、孙家栋 B.谷超豪、钱学森
C.钱学森、袁隆平 D.孙家栋、袁隆平
1.2010 年 1 月 10 日 , 在全国科技工作会议上 , 广州获得 授牌。( )
A.全国卫生文明城市 B.国家森林城市
C.国家创新型试点城市 D.全国旅游文明城市
31、(6分)实验室有三瓶没有标签的无色溶液,它们分别是硫酸、硫酸钠溶液、碳酸钠溶液。现只有生锈铁钉,没有其他试剂,设计一个实验方案进行鉴别,并完成实验报告。
|
实验步骤 |
实验现象与结论 |
|
1、 |
|
|
2、 |
|
30.(7分)大气中CO2含量的增加会加剧温室效应,为寻找处理CO2,减少其排放的方法,某化学兴趣小组的同学设计了实验室制取CO2,并将CO2转化的实验。制取CO2装置图如下:
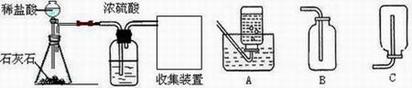
 将CO2转化的实验流程为:
将CO2转化的实验流程为:
请你帮助他们回答下列问题:
(1) 写出实验室制取CO2的化学方程式 ;
(2)浓硫酸的作用是 ,收集装置为 (填字母)
(3)实验流程中CO2转化的最终产物为 (填化学式,下同),在此过程中可循环利用的物质是 。
29.(5分)小明设计了如下图所示的实验装置来证明氧化铜能加快过氧化氢溶液的分解,并与相同条件下MnO2的催化效果做比较,实验时间均以生成30 mL气体为准(即比较反应速率)。用图示装置测量产生气体的体积,其它可能影响实验因素均已忽略,相关数据如下:
|
实验序号 |
过氧化氢溶液体积 |
催化剂 |
待测数据 |
|
① |
15mL |
无 |
? |
|
② |
15mL |
CuO(0.5g) |
? |
|
③ |
15mL |
MnO2(0.5g) |
? |
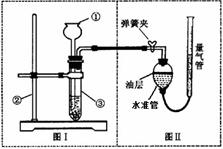
(1) 检查图(I)装置气密性的方法是: ;
(2)检查图(Ⅱ)装置气密性的方法是: ;
(3)图(Ⅱ)装置中油层的作用是 。
(4)从设计原理看,实验中的“待测数据”可以是指 。
(5)为了测量气体体积,在读取反应前后量气管中读数的过程中,应注意 (填字母编号)。
a.视线与凹液面最低处相平
b.读数前不能移动量气管和水准管
c.保持水准管静止,待水准管中液面不再上升时,立刻读数
d.读数前应上下移动水准管,待两管液面相平再读数
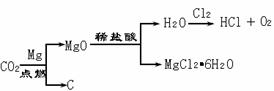
27.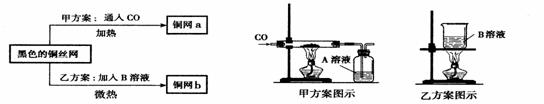 (5分)某化学实验小组为了除去混在N2中的O2,将混合气体通过红热的铜丝网后,发现铜丝网变黑。在研究如何除去黑色物质,回收再利用铜丝网的讨论中,制定了下列方案。
(5分)某化学实验小组为了除去混在N2中的O2,将混合气体通过红热的铜丝网后,发现铜丝网变黑。在研究如何除去黑色物质,回收再利用铜丝网的讨论中,制定了下列方案。
请根据以上方案回答:
(1)乙方案的烧杯中发生反应的化学方程式是(其中B物质自行确定)_________。两种方案相比较,甲方案明显的不足之处是_____________。
(2)若采用甲乙两种方案处理此黑色铜丝网,则回收的铜丝网a的质量 (填“<”、“>”、“=”)铜丝网b的质量。
(3)实验小组的同学发现,按乙方案反应后烧杯中的液体有腐蚀性,应加以适当的处理。他们采取加入铁粉的方案处理废液。加入足量的铁粉充分搅拌,最后得到的溶液中溶质为______________。
28(9分)有一种工业废水,其中含有大量的硫酸镁,少量的银离子以及污泥。某同学设计了一个既经济又合
理的方法回收银和硫酸镁晶体。方案流程如下:
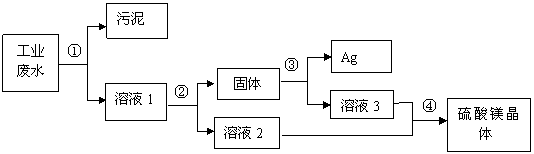
回答下列问题:
(1)步骤②中:需加入的物质是 。
(2)步骤③中:需加入的物质是 ,当观察到_____________________时,则停止加入该物质,发生反应的化学方程式是 。
(3)某同学认为经过步骤②后所得固体就是纯净的银,不需要进行步骤③,你认为是否合理? ,理由是 .
(4)步骤④的操作是 ,溶液2和溶液3为什么要混合? .
26.(8分)为了测定某品牌食用纯碱中碳酸钠的质量分数,某校化学研究性学习小组的探究过程如下:
[提出问题]样品中碳酸钠的质量分数是多少?
[知识准备]食用纯碱的主要成分是碳酸钠,另外还含有少量的氯化钠;
[设计方案并实验]
甲组同学:称取12.00样品,加水配成溶液,在溶液中加入过量澄清石灰水,过滤、洗涤、干燥,共得到白色沉淀10.00g。
乙组同学:称取12.00样品,加入足量的稀盐酸直到反应停止,共收集到4.4g二氧化碳。
[解决问题]
(1)请你任选一组同学的实验结果,帮助他们计算出样品中碳酸钠的质量是 ,碳酸钠的质量分数是 。(计算结果精确到0.1%)
[交流反思]
(2)甲组的小青同学认为,要求出碳酸钠的质量,也可以使用与盐酸和石灰水所属类别不同的其他物质 (填一种具体物质的化学式)的溶液与样品反应,通过测定相关物质的质量,进行有关计算即可。
(3)乙组的小雨同学认为,所用稀盐酸的溶质质量分数也可求出:取13.5g样品放入烧杯中,每次加入20g稀盐酸(不考虑水、氯化氢逸出)后用精密仪器称量,记录实验数据如下:
|
加入稀盐酸次数 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
烧杯及所称物质总质量/g |
78.9 |
97.8 |
116.7 |
135.60 |
155.05 |
175.05 |
195.05 |
|
生成气体的质量/g |
1.1 |
2.2 |
a |
4.4 |
4.95 |
b |
|
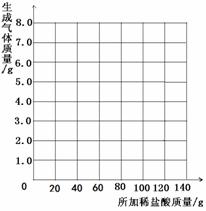 表中数据a=
g,b=
g。
表中数据a=
g,b=
g。
并请你在下边的坐标纸上绘制生成气体的质量
与所加稀盐酸质量关系的曲线。
25. (4分)下表列出了KNO3在不同温度下的溶解度。
|
温度/℃ |
0 |
20 |
40 |
60 |
80 |
100 |
|
溶解度/g |
13.3 |
31.6 |
63.9 |
110 |
169 |
246 |
(1)由上表可推出KNO3溶解度曲线的变化规律是 。
(2)20℃时,把40 g KNO3放入小烧杯中,然后再加100 g水不断搅拌,形成溶液的质量
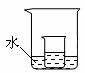 为
g;该溶液是 (填“饱和”或“不饱和”)溶液。
为
g;该溶液是 (填“饱和”或“不饱和”)溶液。
(3)如右图所示,把上述(2)中的小烧杯放到盛水的大烧杯中。若将少量的下列物质分别小心地加入到大烧杯的水中,不断搅拌,能够使小烧杯中的KNO3溶液溶质的质量分数增大的是 (填序号)。
①浓硫酸 ②硝酸铵 ③氢氧化钠 ④冰
24.(2分)中央电视台<<幸运52>>节目中有一道这样的题目, 根据左边提示猜测这是何种物质,请你在右边的横线上写出其化学式.
 (1)
(1)
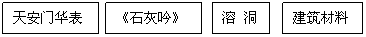
(2)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com