
32.(20分)智能温室无土栽培作物,易于管理,优质高产。该项技术广泛应用于现代农业。
(1)无土栽培所用营养液中的无机盐在植物体内的作用是_____________和________。植物因种类和生长发育阶段不同对无机盐的需求也不同,所以应视具体情况调整____________。供作物__________性吸收无机盐离子。
(2)营养液中某些无机盐离子浓度比根细胞内的低,植物仍可通过____________方式吸收。若栽培池内较长时间通气不畅,作物根部可能出现的症状是___________,其生理原因是____________。
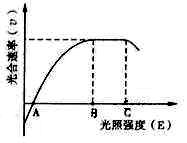 (3)下图表示温室内光照强度(E)与作物光合速率(v)的关系。在温度、水分和无机盐均适宜的条件下,当E<B时,增大光合速率的主要措施是____________;当B<E<C时,限制作物增产的主要因素是____________;当E>C时,可采取____________措施,保证作物的最大光合速率,如遇连阴天,温室需补光,选用____________光最有效。
(3)下图表示温室内光照强度(E)与作物光合速率(v)的关系。在温度、水分和无机盐均适宜的条件下,当E<B时,增大光合速率的主要措施是____________;当B<E<C时,限制作物增产的主要因素是____________;当E>C时,可采取____________措施,保证作物的最大光合速率,如遇连阴天,温室需补光,选用____________光最有效。
(4)用适宜浓度的2,4,-D处理番茄花蕾可提高坐果率。请设计实验方案,确定施用2,4-D的最适浓度。______________________________________________。
31.(14分)
Ⅰ.甲图表示夏季晴朗无云的某天,温室中某种植物二氧化碳吸收和释放速率变化曲线,请据图回答问题:
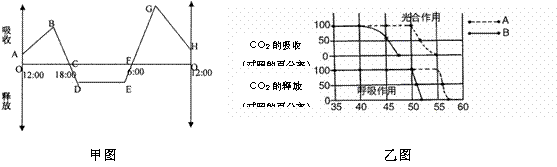
①在24小时内,植物光合作用强度和呼吸作用强度相等的是_________点所对应时刻。
②在24小时内,植物内积累有机物速度最快的是__________点所对应时刻。
③在一天内,植物积累有机物量等于__________。(用图形面积表示,如SOABC)(2分)
④一天中,叶肉细胞叶绿体中C5含量最高的是图中的__________(2分)点所对应的时刻。此时,如果采取___________________措施,既可提高光合产量,又可降低C5含量。
分别于E、G两点对应的时刻,取该植物相同部位的叶片制切片,经碘液染色,观察叶肉细胞的颜色。上述操作的缺陷是____________________(2分)。经改进,实验结果是E点比G点颜色__________(深、浅)。
Ⅱ若测定A、B两种植物的叶片在不同温度下光合作用和呼吸作用速率结果如乙图所示。对照实验是在30℃时进行的。请回答:(注:每一项温度处理的光合作用和呼吸作用速率,以与30℃时的数据比较所得的百分率表达。)
(1)当温度超过 ℃后,植物B的呼吸作用就会受抑制;这两种植物中,最可能原产于热带地区的是 。
(2)写出在高温时导致光合作用受抑制的两个原因。① ;② 。
(3)对A、B植物而言,光合作用对高温较为敏感,支持这一观点的实验证据是 。
(4)在其他条件下不变的情况下,当气温由40℃升至45℃的过程中,植物B的叶绿体中ATP的合成速率 (选填“加快”、“不变”或“降低”)。
30.(15分)2007年度诺贝尔化学奖获得者格哈德·埃特尔建立了合成氨反应机理,T=673K时,各步反应的能量变化如图所示,图中的能量单位为kJ·mol-1。(注:图中“吸”表示在催化剂表面的吸附)请回答下列问题:
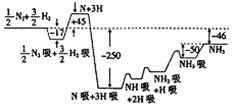 (1)合成氨反应的机理为
(1)合成氨反应的机理为
① ;


 ②N: N2吸
2N
2N吸
②N: N2吸
2N
2N吸
③ ;
 ④NH吸+H吸
NH2吸;
④NH吸+H吸
NH2吸;

 ⑤NH2吸+H吸
NH3吸 NH3。
⑤NH2吸+H吸
NH3吸 NH3。
(2)T=673K时,合成氨反应的热化学方程为 。
(3)液氨与水颇为相像,它能溶解多种无机及有机分子,其电离方程式可表示为:
 2NH3 NH+4+NH-2(某温度下其离子积常数为10-20)。液氨中的pNH4与水中的pH类似,则该温度下液氨的pNH4=
。
2NH3 NH+4+NH-2(某温度下其离子积常数为10-20)。液氨中的pNH4与水中的pH类似,则该温度下液氨的pNH4=
。
(4)盐酸肼(N2H4Cl2)是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与NH4Cl类似。写出盐酸肼第一步水解反应的离子方程式 。
29、(15分)回答有关乙烯的几个问题:
(1)写出实验室制取乙烯化学方程式
(2)配平乙烯与中性或弱碱性高锰酸钾溶液反应的离子方程式(将化学式或化学计量数填入下面相应的方框内)。

(3)乙烯和氢气组成的混合气体中碳氢两元素的质量比为12:5,则该混合气体中乙烯的体积分数为 。
(4)已知卤代烃R-Cl在一定条件下可发生如下反应:
R-Cl+KCN→R-CN+ KCl, R-CN+2H2O+H+→R-COOH+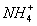 ,
,
 以乙烯为原料经过下图所示的反应可制取有机物W(A、B、C、D、E均为烃的衍生物)
以乙烯为原料经过下图所示的反应可制取有机物W(A、B、C、D、E均为烃的衍生物)
①若甲为HCl,乙为Cl2,生成物W的分子式为C5H10O3,则W的结构简式为:______ ___。
②若甲为Cl2,乙为Br2。W为高分子写出C+E→W的化学方程式:
____________________________ ____。
(5)写出乙烯的两种用途:___ ___
(6)120℃、101kPa下,x L由乙烯和氢气组成的混合气体在y L O2中完全燃烧后,恢复到原温度和压强。若燃烧后气体体积缩小了 L,则x和y关系的数学表达式为 。
L,则x和y关系的数学表达式为 。
28、(15分)苯的含氧衍生物A的相对分子质量为180,其中碳元素的质量分数为60%,A完全燃烧消耗O2的物质的量与生成CO2的物质的量相等。请回答下列问题:
(1)A的分子式为_____________。
(2)A的苯环上取代基彼此相间,A能发生银镜反应,也能与NaHCO3溶液反应产生CO2,还能与FeCl3溶液发生显色反应,则A含有的官能团名称是____________________,
写出A可能的两种结构简式:____________ __、________ _____。
写出其中一同分异构体发生银镜反应的化学方程式:________ _____
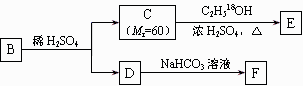
(3)A的一种同分异构体B是邻位二取代苯,其中一个取代基是羧基,B能发生右图所示转化:F的结构简式是_______________;
写出下列反应的化学方程式:
①C→E ______________________________________________________
②D与浓溴水反应 ____________________________________________
③B与足量NaOH溶液共热 ________________________________________________
27.(15分)A、B、C、D、E、F是周期表前30号元素中的六种元素,它们的原子序数依次增大,三种为金属元素、三种为非金属元素。常温下,A、E两种元素所形成的常见单质为气体,B、C、D、F四种元素所形成的常见单质为固体,实验室通常将B单质保存在煤油中,单质B与单质A因反应条件不同生成两种不同的化合物甲和乙。C和E元素的原子均只有一个未成对P电子。D和F两元素形成的某种化合物是硫酸工业的常用原料。
回答下列问题:
(1)F元素在周期表中的位置为 ,F原子基态时核外电子排布式 。
(2)甲、乙均能与水反应,但甲与水发生的反应属于氧化还原反应,写出甲的电子式 ,写出甲与水发生反应的化学方程式并标出电子转移的方向和数目: 。
(3)F的一种红褐色氢氧化物与E的单质、B的最高价氧化物对应的水化物三种物质作用可生成一种净水剂B2FA4,试写出该反应的化学反应方程式为:
26.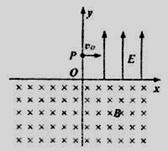 (21分)如图,在xoy平面内,Ⅰ象限中有匀强电场,场强大小为E,方向沿y轴正向,在x轴下方有匀强磁场,磁感强度大小为B,方向垂直于纸面向里。今有一个质量为m电量为e的电子(不计重力),从y轴上的P点以初速度
(21分)如图,在xoy平面内,Ⅰ象限中有匀强电场,场强大小为E,方向沿y轴正向,在x轴下方有匀强磁场,磁感强度大小为B,方向垂直于纸面向里。今有一个质量为m电量为e的电子(不计重力),从y轴上的P点以初速度
v0垂直于电场方向进入电场。经电场偏转后,沿着与x轴正方
向成45°进入磁场,并能返回到原出发点P。求:
(1)作出电子运动转迹的示意图
(2)P点离坐标原点的距离h。
(3)电子从P点出发经多长时间第一次返回P点?
25.(18分)物体沿质量为M、半径为R星球的表面做匀速圆周运动所需的速度v1叫做该星球第一宇宙速度;只要物体在该星球表面具有足够大的速度v2,就可以脱离该星球的万有引力而飞离星球(即到达到距星球无穷远处),这个速度叫做该星球第二宇宙速度。理论上可以证明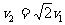 。一旦该星球第二宇宙速度的大小超过了光速C=3.0×108m,则该星球上的任何物体(包括光子)都无法摆脱该星球的引力,于是它就将与外界断绝了一切物质和信息的交流。从宇宙的其他部分看来,它就像是消失了一样,这就是所谓的“黑洞”。试分析一颗质量为M=2.0×1031kg的恒星,当它的半径坍塌为多大时就会成为一个“黑洞”?(计算时取引力常量G=6.7×10-11Nžm2/kg2,答案保留一位有效数字.)
。一旦该星球第二宇宙速度的大小超过了光速C=3.0×108m,则该星球上的任何物体(包括光子)都无法摆脱该星球的引力,于是它就将与外界断绝了一切物质和信息的交流。从宇宙的其他部分看来,它就像是消失了一样,这就是所谓的“黑洞”。试分析一颗质量为M=2.0×1031kg的恒星,当它的半径坍塌为多大时就会成为一个“黑洞”?(计算时取引力常量G=6.7×10-11Nžm2/kg2,答案保留一位有效数字.)
24. (15分)杂技演员在进行“顶杆”表演时,用的是一根质量可忽略不计的长竹竿,质量为30 kg的演员自杆顶由静止开始下滑,滑到杆底时速度正好为零.已知竹竿底部与下面顶杆人肩部之间有一传感器,传感器显示顶杆人肩部的受力情况如图所示,取g= 10
m/s2.求:
(15分)杂技演员在进行“顶杆”表演时,用的是一根质量可忽略不计的长竹竿,质量为30 kg的演员自杆顶由静止开始下滑,滑到杆底时速度正好为零.已知竹竿底部与下面顶杆人肩部之间有一传感器,传感器显示顶杆人肩部的受力情况如图所示,取g= 10
m/s2.求:
(1)杆上的人下滑过程中的最大速度;
(2)竹竿的长度.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com