
29.(15分)工业上以铁铜混合物为原料采取如下图所示流程制备硝酸铜晶体和聚合硫酸铁(是一种新型高效的无机高分子絮凝剂,广泛用于水的处理)。制备聚合硫酸铁过程中,为控制水解时Fe3+的浓度,防止生成氢氧化铁沉淀,原料中的Fe3+必须先还原为Fe2+。实验步骤如下:

(1)在步骤a中,还需要通入氧气和水,其目的是 。
(2)在保温去铁的过程中,为使Fe3+沉淀完全,可以向溶液中加入CuO,调节溶液的pH,根据下表数据,溶液的pH应保持在 范围。
|
|
氢氧化物开始沉淀时的pH |
氢氧化物沉淀完全时的pH |
|
Fe3+ |
1.9 |
3.2 |
|
Cu2+ |
4.7 |
6.7 |
(3)进行蒸发浓缩时,要用硝酸调节溶液的pH=1,其目的是(结合离子方程式说明)
。
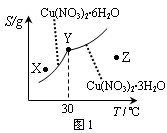 (4)右下图1是某小组同学查阅资料所绘出的硝酸铜晶体[ Cu(NO3)2·nH2O ]
的溶解度曲线(温度在30℃前后对应不同的晶体)。
下列说法正确的是 (填选项字母)
(4)右下图1是某小组同学查阅资料所绘出的硝酸铜晶体[ Cu(NO3)2·nH2O ]
的溶解度曲线(温度在30℃前后对应不同的晶体)。
下列说法正确的是 (填选项字母)
A.Y点时两种晶体可以共存
B.X点时的溶液为不饱和溶液
C.按上述流程最终得到的晶体是Cu(NO3)2·3H2O
D.若将Z点时的溶液降温至30℃以下,可以析出Cu(NO3)2·6H2O晶体
(5)有同学认为上流程图中步骤II取样分析的溶液中含Fe2+,请你设计实验加以证明。(写出操作、现象、结论)
。
(6)写出上流程图中第IV步中用NaClO3和稀硫酸氧化FeSO4的离子反应方程 :
。
28.(16分)利用芳香烃X和链烃Y可以合成紫外线吸收剂BAD,BAD的结构简式为:
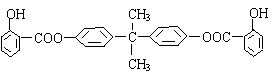
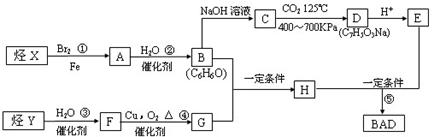
试回答下列问题:
(1)1 mol BAD最多可与含 mol NaOH的溶液完全反应
(2)在①~⑤反应中属于取代反应的有 (填①~⑤反应序号)
(3)E的同分异构体中含有苯环,苯环上一氯取代产物有两种结构,且能发生银镜反应的分
子。写出其中一种的结构简式 。
(4)写出下列反应的化学方程式
反应①: ;
B+G→H: 。
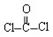
(5)H还能和光气( )合成一种可用于制作防弹窗户的高强材料Lexan聚碳
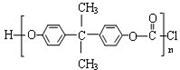
酸酯( ),写出此合成反应的化学方程式:
_____________________ ____
27.(16分)原子数相同、电子数也相同的物质,互称为等电子体。等电子体的结构相似、物理性质相近。该原理被广泛使用于一些具有特殊功能的晶体的发现和人工合成等诸多领域。如:X是一种新型材料,与碳化硅(SiC)互称为等电子体。X有如下图所示的转化:其中,C是一种能使湿润的红色石蕊试纸变蓝的无色气体,D在溶液中为白色胶状沉淀,E溶液的焰色反应中火焰呈黄色。(图中某些反应条件已略去)
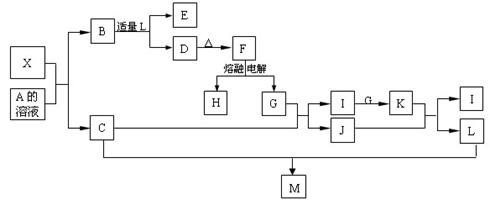
请回答以下问题:
(1)F的化学式为________,X物质属于_______晶体(填“原子”、“分子”或“离子”)。
(2)按要求写出下列反应方程式:
①K+J→I+L 的离子方程式 ;
②X+A溶液→B+C的化学方程式 。
(3)X与SiC的复合粉末是新一代大规模集成电路的理想散热材料。该复合粉末制备原理如
下,请将该反应补充完整(方框中填新物质的化学式)。
 + 2N2
+ 2N2 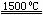 4X + SiC + 3C
4X + SiC + 3C
(4)某化肥厂用C与L制备M。已知由C制备L过程中利用率为60%,C制备M过程中吸收率
为90%。当制备L中消耗的C占参与反应的C的质量分数为 时,M产率最高。
26.(13分)A、B、C、D、E是五种常见的短周期元素,它们的原子序数依次增大;其中C元素原子最外层电子数是次外层电子数的3倍,B元素原子的最外层电子数比C元素原子的最外层电子数少1个;A元素和D元素、C元素和E元素分别同主族;又知C、E两种元素的原子序数之和是A、D两种元素的原子序数之和的2倍。请回答下列问题:
(1)写出由A、C、D三种元素形成的化合物的电子式 。
(2)下列比较不正确的是 (填选项字母)
A.原子半径:D>B>C>A B.稳定性:A2E>A2C
C.沸 点:A2E>BA3>A2C D.熔 点:D2C>BA3
(3)由A元素与C元素按1︰1形成的化合物与E的氢化物反应的化学反应方程式为:
(4)常温下,a g E元素的单质在C元素的单质中完全燃烧放出Q kJ的热量,写出表示E元素单质燃烧热的热化学方程式:
。
(5)由B元素的氢化物与C元素的单质、KOH溶液构成燃料电池,负极产生B元素的单质,则负极电极反应式为 。
13.将铁粉和铜粉的均匀混合物平均分成四等份,分别加入同浓度的稀硝酸,充分反应,在标准状况下生成NO的体积和剩余金属的质量如下表(假设硝酸的还原产物只有NO)
|
编号 |
① |
② |
③ |
④ |
|
稀硝酸体积/L |
0.1 |
0.2 |
0.3 |
0.4 |
|
剩余金属/g |
18.0 |
9.6 |
0 |
0 |
|
NO体积/L |
2.24 |
4.48 |
6.72 |
V |
经由计算分析,下列推断正确的是
 A.硝酸的浓度为3 mol/L
B.①中溶解了5.6 g Fe
A.硝酸的浓度为3 mol/L
B.①中溶解了5.6 g Fe
 C.④中V = 6.72
D.③中溶解了9.6 g Cu
C.④中V = 6.72
D.③中溶解了9.6 g Cu
第Ⅱ卷
12.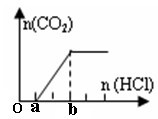 向盛有一定量NaOH溶液的烧杯中通入一定量的CO2气体得到溶液X,向溶液X中逐滴加入稀盐酸至过量,并将溶液加热,产生的CO2气体与HCl物质的量的关系如图(忽略CO2的溶解和HCl的挥发)
向盛有一定量NaOH溶液的烧杯中通入一定量的CO2气体得到溶液X,向溶液X中逐滴加入稀盐酸至过量,并将溶液加热,产生的CO2气体与HCl物质的量的关系如图(忽略CO2的溶解和HCl的挥发)
 。则下列分析正确的是
。则下列分析正确的是
A.溶液X的溶质是NaOH和Na2CO3
B.溶液X中:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)
C.溶液X中:c(Na+)=2[c(HCO3-)+c(CO32-)+c(H2CO3)]
D.a~b段发生反应的离子反应方程式为:CO32-+2H+=CO2↑+H2O
11.工业上制备纯硅的热化学反应方程式为:SiCl4(g)
+ 2H2(g) Si(s) + 4HCl(g);△H = + Q kJ/mol(Q>0)。一定温度、压强下,将一定量的反应物充入密闭容器中进行以上反应。下列叙述正确的是
Si(s) + 4HCl(g);△H = + Q kJ/mol(Q>0)。一定温度、压强下,将一定量的反应物充入密闭容器中进行以上反应。下列叙述正确的是
A.反应过程中,若增大压强能提高SiCl4的转化率
B.当反应吸收热量为0.025Q kJ时,生成0.1molHCl
C.若反应开始时H2为2 mol,则达到平衡时,吸收热量为Q kJ
D.反应至4 min时,若HCl的浓度为0.12 mol/L,则H2的反应速率为0.03 mol/(L·min)
10.每年的6月26日是国际禁毒日。以下是四种常见毒品的结构简式,下列有关说法正确的是

A.摇头丸经消去、加成反应可制取冰毒
|
C.1mol大麻与溴水反应最多消耗4mol Br2
D.氯胺酮分子中环上所有碳原子可能共平面
9.下列实验操作或对实验事实的描述正确的是
A.圆底烧瓶、锥形瓶、蒸发皿加热时都应垫石棉网
B.实验室配制一定物质的量浓度的溶液时,俯视容量瓶的刻度线,会使配制的溶液的浓度偏高
C.碱金属单质的化学性质很活泼,实验室通常将少量Li、Na、K 保存于煤油中
D.检验醛基时先在试管中加入5mL2%的CuSO4溶液,再滴加4-8滴2%的NaOH溶液,然后加入适量的乙醛,煮沸,观察是否有红色沉淀产生
8.下列反应的离子方程式书写正确的是
A.氯气通入水中:Cl2+H2O=2H++ClO-+Cl-
B.氢氧化铁溶于氢溴酸(HBr)中:Fe(OH)3+3H++2Br-= Fe2++Br2+3H2O
C.向AlCl3溶液中投入少量的Na2O2 :6Na2O2+6H2O+4Al3+ =4Al(OH)3↓+3O2↑+12Na+
D.向Ba(OH)2溶液中逐滴加入NaHSO4溶液至溶液刚好呈中性:
Ba2++OH-+H++SO42-=BaSO4↓+H2O
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com