
6. 人排成一排,则甲不站在排头的排法有 ▲ 种.
人排成一排,则甲不站在排头的排法有 ▲ 种.
5.已知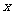 ,
,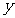 的取值如下表所示:
的取值如下表所示:
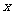 |
0 |
1 |
3 |
4 |
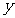 |
2.2 |
4.3 |
4.8 |
6.7 |
从散点图分析,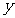 与
与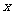 线性相关,且
线性相关,且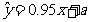 ,则
,则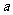 的值为 ▲ .
的值为 ▲ .
4.点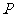 的极坐标为
的极坐标为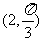 ,以极点为直角坐标系的原点,极轴为
,以极点为直角坐标系的原点,极轴为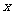 轴正半轴,建立直角坐标系,且在两种坐标系中取相同的长度单位,则
轴正半轴,建立直角坐标系,且在两种坐标系中取相同的长度单位,则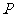 点的直角坐标为 ▲ .
点的直角坐标为 ▲ .
3. +
+ 的值为 ▲ .
的值为 ▲ .
2.执行下列伪代码,输出的结果为 ▲ .
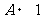
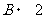
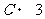
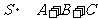
Print 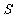
1.复数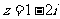 (
(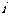 为虚数单位)在复平面上对应的点在第 ▲ 象限.
为虚数单位)在复平面上对应的点在第 ▲ 象限.
13.(14分)
(1) 、 、 、 。
(2) , 。
(3) ; 。
(4) 。
(5) 。
(6) 。

(1) 。
(2) , , 。
(3) 。 (4) 。
(1) 。
(2)Ⅰ ;Ⅳ 。
(3) , 。
(4) ; ; 。
(1) ; 。
(2) ,
① , 。
② 。
③ 。
④ , 。
(3) 。
(1) 。(2) 。
(3) 。(4) 。

(1) 。
(2)① ② 。
(3) 。
⑴ 。
, 。
⑵ 。
⑶① , 。
② 。
。
 (4)
(4)
19.(14分)铜是第四周期重要的过渡元素之一,其单质及化合物具有广泛用途。
请回答下列有关问题:
⑴ 铜原子的基态电子排布式是 ▲ 。比较第一电离能Cu ▲ Zn(填 “>”、“=”、“<”),说明理由 ▲ 。
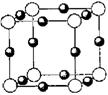 ⑵氮和铜形成某种化合物的晶胞结构如右图所示,则其化学式为 ▲ 。(每个球均表示1个原子)
⑵氮和铜形成某种化合物的晶胞结构如右图所示,则其化学式为 ▲ 。(每个球均表示1个原子)
⑶铜可以形成多种多样的配合物。
① NH3可以和很多过渡金属形成配合物。NH3分子中心原子的杂化类型为 ▲ 杂化,与NH3互为等电子体的粒子有 ▲ 。(只写其中一种)
②向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解得到深蓝色的透明溶液。试用离子方程式表示其原因 ▲ 、 ▲ 。
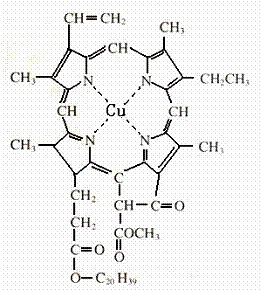
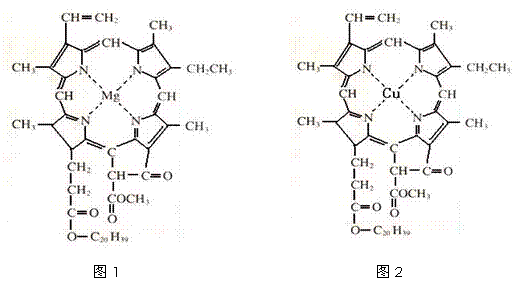
⑷在绿色植物标本的制作过程中,将植物材料洗净后浸入5%的硫酸铜溶液中,叶绿素(如图1)中心离子Mg2+被置换成Cu2+(如图2),叶片则永保绿色,请在图2中用箭头表示出配位键。
 2009-2010学年度第二学期期末考试
2009-2010学年度第二学期期末考试
高二化学答题纸 得分

 第Ⅰ卷 选择题(共42分)
第Ⅰ卷 选择题(共42分)
第Ⅱ卷
|
|
|
18.(8分)在含有弱电解质的溶液中,往往有多个化学平衡共存。
⑴现将0.04mol·L-1的HA溶液与0.02mol·L-1的NaOH溶液等体积混合。如HA是HCN,溶液中c(Na+)>c(CN-),则该混合溶液c(H+) ▲ c(OH-)(请填“>”“<”或“=”),c(HCN)+c(CN-)= ▲ mol·L-1。如HA是CH3COOH,该混合溶液呈酸性,c(CH3COOH) ▲ c(CH3COO-)(请填“>”、“<”或“=”)。
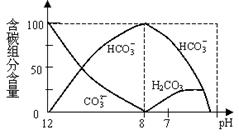
⑵常温下在20mL0.1mol/L Na2CO3溶液中逐滴加入0.1mol/L HCl溶液40mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数(纵轴)随溶液pH变化的部分情况如下图所示。回答下列问题:
①在同一溶液中,H2CO3、HCO3-、 CO32- ▲ (填:“能”或“不能”)大量共存。
②当pH=7时,溶液中各种离子其物质的量浓度之间的等量关系是: ▲ 。
⑶已知在25℃时,CO32-水解反应的平衡常数即水解常数
Kh==2×10-4,当溶c(HCO3-)︰c(CO32-)=20︰1时,溶液的pH=_▲_。
17.(8分)到目前为止,由化学能转变的热能或电能仍然是人类使用最主要的能源。
请回答下列问题:
⑴2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) △H=-2599kJ·mol-1,
则乙炔的燃烧热为 ▲ 。
⑵有些反应进行得很慢,有些反应不容易直接发生,有些反应的产品不纯(有副反应发生),这给测定反应热造成了困难,此时可利用盖斯定律,就可以间接地把它们的反应热计算出来。已知
①CO(g)+1/2O2(g)=== CO2(g) ΔH1=-283.0kJ·mol-1
②C(s)+O2(g)===CO2(g) ΔH2=-393.5kJ·mol-1
则C(s)+1/2O2(g)=CO(g) ΔH = ▲ 。
⑶从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程。已知键能数据如下表。
|
化学键 |
键能(kJ/mol) |
化学键 |
键能(kJ/mol) |
|
N≡N |
942 |
H-O |
460 |
|
N-H |
391 |
O=O |
499 |
|
H-H |
437 |
|
|
反应N2+3H2 2NH3
△H=a kJ·mol-1。试根据表中所列键能数据估算a 的数值 ▲ 。
2NH3
△H=a kJ·mol-1。试根据表中所列键能数据估算a 的数值 ▲ 。
⑷最近美国Simons等科学家发明了不必使氨先裂化为氢就可直接用于燃料电池的方法。该方法既有液氢燃料电池的优点,又克服了液氢不易保存的不足。其装置为用铂黑作为电极,插入强碱溶液中,一个电极通入空气,另一电极通入氨气。其电池总反应为4NH3+3O2═2N2+6H2O。试写出负极电极反应式 ▲ 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com