
11.下列溶液中微粒的物质的量浓度关系正确的是
A.NaHCO 3溶液中:c(H+)+c(Na+)=c(OH-)+c(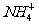 )+c(
)+c(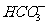 )
)
B.pH=3的CH 3 COOH与pH=11的NaOH溶液等体积混合后的溶液中:
c(H+)<c(OH-)
C.0.1mol/L的NH4Cl溶液中:c(Cl-)>c(H+)>c(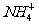 )>c(OH-)
)>c(OH-)
D.物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合后的溶液中:
2c(Na+)=c(CH3COOH)+c(CH3COO-)
10.下列说法中正确的是
A.在相同条件下,将等量的硫蒸气和硫固体分别完全燃烧,后者放出热量多
B.由“C(s,石墨)=C(s,金刚石)△H=+1.9kJ·mol-1”可知,金刚石比石墨稳定
C.在稀溶液中:H+(aq)+OH-(aq)=H2O(1)△H=-57.3kJ·mol-1,若将含0.5mol
H2SO4的浓硫酸与含lmol NaOH的溶液混合,放出的热量大于57.3 kJ
D.在101kPa时,2g H 2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H 2(g)+O 2(g)=2H 2 O(1)△H=-285.8kJ·mol-1
9.X、Y、Z、W是原子序数依次增大的短周期元素,且均在不同族,其中两种为金属;X原子的最外层电子数与次外层电子数相等;X与W、Y与Z这两对原子的最外层电子数之和均为9。下列说法不正确的是
A.YW3水溶液蒸干可得YW3固体 B.原子半径:Y>Z>W

8.设NA代表阿伏加德罗常数的数值,下列说法中正确的是
①常温常压下,8g甲烷(12CH4)所含的中子数为5NA
②常温常压下,22.4 L N2气体的分子数小于NA
③64g铜发生氧化还原反应,一定失去2NA个电子
④常温常压下,0.5moL/L的乙酸溶液中,乙酸的分子数目略小于0.05NA
⑤标准状况时,22.4L氧单质中氧原子数可能为2.5NA
⑥常温常压下,1mol氦气分子含有的核外电子数为4NA
A.①② B.③④ C.②⑤ D.⑤⑥
7.下列各组离子在指定溶液中可能大量共存的是
①无色溶液:K+、Cu2+、Na+、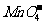 、
、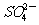
②pH=11的溶液: 、Na+、
、Na+、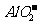 、
、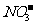
③加入Al能放出H2的溶液:Cl-、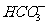 、
、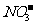 、
、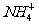
④常温下水电离出的c(H+)·c(OH-)=1×10-20的溶液:Na+、Cl-、S2-、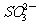
⑤能使甲基橙试液变红的无色溶液:Na+、 、K+、ClO-、
、K+、ClO-、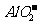
⑥酸性溶液:Fe2+、Al3+、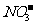 、I-、Cl-
、I-、Cl-
A.①②⑤ B.②④ C.②④⑤ D.①②④
6.下列化学反应式书写正确的是
A.制取氢氧化铁胶体的化学方程式为:FeCl3+3H2O Fe(OH)3(胶体)+3HCl
Fe(OH)3(胶体)+3HCl
B.亚硫酸在溶液中的电离方程式为:H2SO3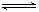 2H++
2H++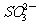
C.NaHCO3水解的离子方程式为: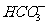 +H2O
+H2O
 +H3O+
+H3O+
D.电子工业印刷电路反应式为:2Fe3++Cu=Cu2++2Fe2+
5.下列各项操作中,不发生“先产生沉淀,然后沉淀又溶解”现象的是
①向饱和碳酸钠溶液中通入过量的CO2 ②向Fe(OH)3胶体中逐滴加入过量的稀盐酸
③AgNO3溶液中逐滴加入过量氨水 ④向硅酸钠溶液中逐滴加入过量的盐酸
A.①② B.②③ C.①③ D.①④
4.共价键、离子键、范德华力和氢键是形成晶体的粒子之间的四种作用力。下列晶体:
①Na2O2 ②固体氨 ③NaCl ④SiO2 ⑤冰 ⑥干冰,其中含有三种作用力的是
A.①②③ B.①②⑥ C.②⑤ D.⑤⑥
3.下图为课本中的插图,下列操作不合理的是

A.切割钠 B.过氧化钠与水反应C.钾的焰色反应 D.铜丝在氯气中燃烧
2.分类方法在化学学科的发展中起到了非常重要的作用。下列分类标准合理的是
①根据酸分子中含有的氢原子数将酸分为一元酸、二元酸等,②根据反应中是否有电子转移将化学反应分为氧化还原反应和非氧化还原反应,③根据分散系是否具有丁达尔现象将分散系分为溶液、胶体和浊液,④根据反应中的热效应将化学反应分为放热反应和吸热反应。
A.①③ B.②④ C.①②④ D.②③④
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com