
11.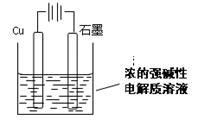 Cu2O是一种半导体材料,基于绿色化学理念设计的制取Cu2O的电解池示意图如下,电解总反应:2Cu+H2O
Cu2O是一种半导体材料,基于绿色化学理念设计的制取Cu2O的电解池示意图如下,电解总反应:2Cu+H2O Cu2O+H2
Cu2O+H2 。下列说法正确的是
。下列说法正确的是
A.石墨电极上产生氢气
B.铜电极发生还原反应
C.电解过程中电子从电源正极流出经导线流向铜极
D.当有0.1mol电子转移时,有0.1molCu2O生成
10.下列反应的离子方程式正确的是
A.用氨水溶解氯化银沉淀:Ag++2 NH3·H2O=[Ag(NH3)2]++2 H2O
B.用醋酸除去水垢中的碳酸盐: 2CH3COOH+CO32- 2CH3COO-+H2O+CO2↑
2CH3COO-+H2O+CO2↑
C.工业上电解食盐水制备Cl2: 2Cl-+2H2O 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
D.钢铁发生吸氧腐蚀的正极反应: 2H2O + O 2+4e-=4OH-
9.在指定环境中,下列各组离子可以大量共存的是
A.在中性溶液中:Al3+、K+、SO42-、HCO3-
B.由水电离出的c(H+)=1×10 -12mol·L -1的溶液中:K+、Cl-、NO3-、Na+
C.在强碱性溶液中:K+、Na+、Cl-、AlO2-
D.在强酸性溶液中:NO3-、K+、I-、Na+
8.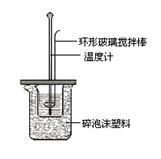 下列实验操作合理或能达到实验目的的是
下列实验操作合理或能达到实验目的的是
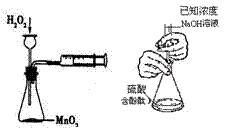
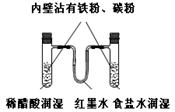
图1 图2 图3 图4
A.图1:实验目的是定量测定化学反应速率
B.图2:用标准NaOH溶液滴定待测H2SO4溶液的物质的量浓度
C.图3:将0.1mol/L 55mLNaOH溶液逐滴加入到0.1mol/L50mL盐酸溶液中测中和热
D.图4:模拟铁的腐蚀实验
7.同组物质中化学键类型相同、晶体类型也相同的是
A. Ar 、N2 、 Si B.金刚石 、 O2 、F2
C. Ba(OH)2 、K2O 、CaCl2 D.NH3 、CO2 、CH4
6.对Na、Mg、Al的有关性质的叙述正确的是
A.碱性:NaOH< Mg(OH)2< Al(OH)3 B.第一电离能:Na< Mg <Al
C.电负性:Na> Mg >Al D.还原性:Na> Mg >Al
不定项选择题(本题包括6小题,每小题4分,共24分。每小题只有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就为0分。)
5.KOH溶液和等体积、等浓度的HA弱酸溶液混合后,溶液中有关离子的浓度应满足的关系是
A.c(K+)>c(OH-)>c(A-)>c(H+) B.c(K+)>c(A-)>c(OH-)>c(H+)
C.c(K+)>c(A-)>c(H+)>c(OH-) D.c(K+)>c(H+)>c(A-)>c(OH-)
4.下列关于晶体的说法正确的是
A.分子晶体中一定含共价键
B.CsCl晶体中Cs+的配位数为6
C.SiO2晶体中每个Si原子与4个O原子以单键结合
D.金属晶体的熔点一定比原子晶体低,一定比分子晶体高
3.关于2SO2(g)+O2(g)2SO3(g),下列叙述正确的是
A.催化剂不改变该反应的逆反应速率
B.在平衡体系中增大SO2的浓度,重新达到平衡后,SO3的含量一定会增大
C.该反应是放热反应,降低温度将缩短反应达到平衡的时间
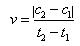 D.在t1、t2时刻,SO3(g)的浓度分别是c1,c2,则时间间隔t1-t2内,SO3(g)生成的平均速率为
D.在t1、t2时刻,SO3(g)的浓度分别是c1,c2,则时间间隔t1-t2内,SO3(g)生成的平均速率为
2.对氨水溶液中存在的电离平衡NH3·H2O NH4++OH-,下列叙述正确的是
NH4++OH-,下列叙述正确的是
A.加水后,溶液中n(OH-)增大
B.加入少量浓盐酸,溶液中n(OH-)增大
C.加入少量浓NaOH溶液,电离平衡向正反应方向移动
D.加入少量NH4Cl固体,溶液中c(NH4+)减少

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com