
14.某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应是:A(g)+xB(g)
 2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化的如下图所示。下列说法中正确是
2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化的如下图所示。下列说法中正确是
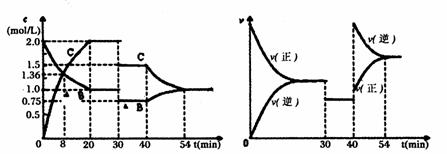
A.8min前正反应速率大于逆反应速率
B.20min时A的反应速率为0.05mol/(L·min)
C.反应方程式中的x=1,正反应为吸热反应
D.30min时降低温度,40min时升高温度
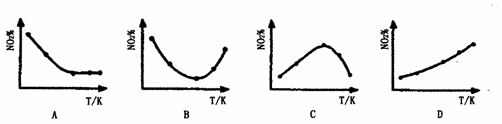
13.取五等份NO2,分别加入温度不同、容积相同的恒容密闭容器中,发生反应:
2NO2(g)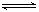 N2O4(g);△H<0
N2O4(g);△H<0
在相同反应时间间隔内,分别测定不同容器中NO2的百分含量(NO2%)并作出其随反应温度(T)变化的关系图,下列示意图中,可能与实验结果相符的是
12.从下列事实所引出的相应结论,正确的是

11.下列溶液中微粒的物质的量浓度关系正确的是
A.NaHCO 3溶液中:c(H+)+c(Na+)=c(OH-)+c(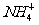 )+c(
)+c(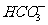 )
)
B.pH=3的CH 3 COOH与pH=11的NaOH溶液等体积混合后的溶液中:
c(H+)<c(OH-)
C.0.1mol/L的NH4Cl溶液中:c(Cl-)>c(H+)>c(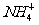 )>c(OH-)
)>c(OH-)
D.物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合后的溶液中:
2c(Na+)=c(CH3COOH)+c(CH3COO-)
10.下列说法中正确的是
A.在相同条件下,将等量的硫蒸气和硫固体分别完全燃烧,后者放出热量多
B.由“C(s,石墨)=C(s,金刚石)△H=+1.9kJ·mol-1”可知,金刚石比石墨稳定
C.在稀溶液中:H+(aq)+OH-(aq)=H2O(1)△H=-57.3kJ·mol-1,若将含0.5mol
H2SO4的浓硫酸与含lmol NaOH的溶液混合,放出的热量大于57.3 kJ
D.在101kPa时,2g H 2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H 2(g)+O 2(g)=2H 2 O(1)△H=-285.8kJ·mol-1
9.X、Y、Z、W是原子序数依次增大的短周期元素,且均在不同族,其中两种为金属;X原子的最外层电子数与次外层电子数相等;X与W、Y与Z这两对原子的最外层电子数之和均为9。下列说法不正确的是
A.YW3水溶液蒸干可得YW3固体 B.原子半径:Y>Z>W

8.设NA代表阿伏加德罗常数的数值,下列说法中正确的是
①常温常压下,8g甲烷(12CH4)所含的中子数为5NA
②常温常压下,22.4 L N2气体的分子数小于NA
③64g铜发生氧化还原反应,一定失去2NA个电子
④常温常压下,0.5moL/L的乙酸溶液中,乙酸的分子数目略小于0.05NA
⑤标准状况时,22.4L氧单质中氧原子数可能为2.5NA
⑥常温常压下,1mol氦气分子含有的核外电子数为4NA
A.①② B.③④ C.②⑤ D.⑤⑥
7.下列各组离子在指定溶液中可能大量共存的是
①无色溶液:K+、Cu2+、Na+、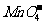 、
、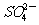
②pH=11的溶液: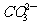 、Na+、
、Na+、 、
、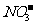
③加入Al能放出H2的溶液:Cl-、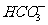 、
、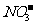 、
、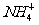
④常温下水电离出的c(H+)·c(OH-)=1×10-20的溶液:Na+、Cl-、S2-、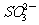
⑤能使甲基橙试液变红的无色溶液:Na+、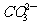 、K+、ClO-、
、K+、ClO-、
⑥酸性溶液:Fe2+、Al3+、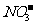 、I-、Cl-
、I-、Cl-
A.①②⑤ B.②④ C.②④⑤ D.①②④
6.下列化学反应式书写正确的是
A.制取氢氧化铁胶体的化学方程式为:FeCl3+3H2O Fe(OH)3(胶体)+3HCl
Fe(OH)3(胶体)+3HCl
B.亚硫酸在溶液中的电离方程式为:H2SO3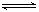 2H++
2H++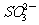
C.NaHCO3水解的离子方程式为: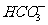 +H2O
+H2O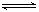
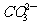 +H3O+
+H3O+
D.电子工业印刷电路反应式为:2Fe3++Cu=Cu2++2Fe2+
5.下列各项操作中,不发生“先产生沉淀,然后沉淀又溶解”现象的是
①向饱和碳酸钠溶液中通入过量的CO2 ②向Fe(OH)3胶体中逐滴加入过量的稀盐酸
③AgNO3溶液中逐滴加入过量氨水 ④向硅酸钠溶液中逐滴加入过量的盐酸
A.①② B.②③ C.①③ D.①④
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com