

4.矩阵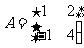 的特征值是__________.
的特征值是__________.
3.曲线C: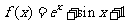 在
在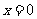 处的切线方程为 .
处的切线方程为 .
2.设复数z满足z(2-3i)=6+4i(其中i为虚数单位),则z的模为_______ __.
1.集合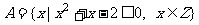 ,则集合A中所有元素之积为 .
,则集合A中所有元素之积为 .
24、有机物A是重要的合成原料,在医药、染料、香料等行业有着广泛的应用。由A可以制得麻黄碱和其他很多物质。现有如下转化关系图(略去了由A→C,G→麻黄碱的部分反应物和条件):
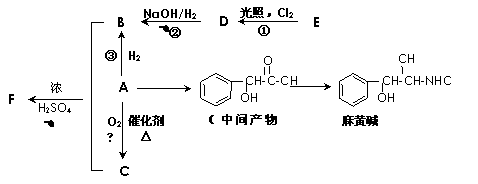
请回答下列问题:
(1)下列关于麻黄碱的说法正确的是 (填字母)。
a.麻黄碱的分子式为C10H15NO b.麻黄碱能与NaOH溶液反应
c.麻黄碱能发生加成和取代反应 d.麻黄碱属于芳香烃
(2)已知有机物A的相对分子质量为106,A中含碳、氢、氧的质量分数之比为42∶3∶8,
则A的含氧官能团名称是 ;检验该官能团的常用试剂是 。
(3)反应①-⑤中属于取代反应的是 (填序号)。
(4)写出D→B的化学方程式 。
(5)F可作多种香精的定香剂,请写出B和C反应生成F的化学方程式 。
(6)写出符合下列条件的同分异构体的结构简式 。
①与中间产物G互为同分异构体
②既能发生消去反应,又能发生酯化反应
③苯环上的一氯取代物只有两种,分子结构中没有甲基
(7)已知:
|
|
溶解性 |
沸点 |
|
A |
微溶于水 |
179.0℃ |
|
E |
不溶于水 |
110.8℃ |
A可以由E制取,制取工艺中得到的是A、E混合物,分离该混合物的方法是 。
23、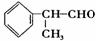 氢化阿托醛
是一种重要的化工原料,其合成路线如下:
氢化阿托醛
是一种重要的化工原料,其合成路线如下:
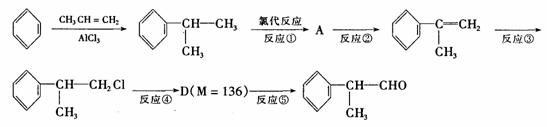
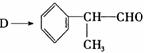 (1)在合成路线上②③的反应类型分别为② ③
。
(1)在合成路线上②③的反应类型分别为② ③
。
(2)由 反应的化学方程式为 。
(3)1mol氢化阿托醛发生银镜反应最多可生成 molAg。
(4)D与有机物X在一定条件下可生成一种相对分子质量为178的酯类物质,则X的结构简式为 。D有多种同分异构体,能满足苯环上有两个取代基,且能使FeCl3溶液显紫色的同分异构体有 种。
22、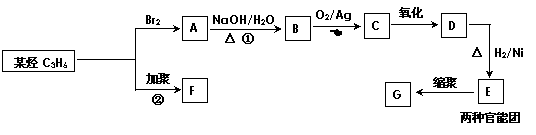 有机物F、G是常见的塑料,可通过下图所示路线合成:
有机物F、G是常见的塑料,可通过下图所示路线合成:
(1)高分子化合物G的结构简式是 。
(2)反应②的化学方程式是 。
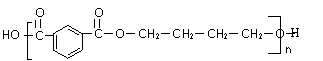 (3)PBT(
)是一种重要的工程塑料。
(3)PBT(
)是一种重要的工程塑料。
结合所学知识,请设计方案以CH2=CHCH=CH2 、 为原料合成PBT(请用反应流程图表示,并注明反应条件)。
示例:由乙醇合成聚乙烯的反应流程图可表示为

|
 CH2=CH2
CH2=CH2
 CH2-CH2
CH2-CH2
合成PBT的反应流程图为:
___________________________________________________________________________
19、某一反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2。
已知该反应中H2O2只发生如下过程:H2O2 → O2
(1)写出该反应的化学方程式,并标出电子转移的方向和数目。
(2)该反应中的氧化剂是 。
(3)若反应转移了0.3 mol电子,则产生的气体在标准状况下体积为 。
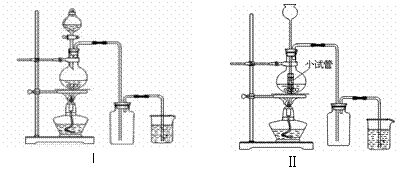 20、某化学小组利用浓盐酸和二氧化锰在加热条件下制取氯气,并利用氯气进行有关的探究实验,制取氯气的装置如图I和Ⅱ。
20、某化学小组利用浓盐酸和二氧化锰在加热条件下制取氯气,并利用氯气进行有关的探究实验,制取氯气的装置如图I和Ⅱ。
(1)制取氯气的反应的离子方程式 ;
(2)装置Ⅱ中小试管的作用为 ;
(3)装置I与装置Ⅱ比较,装置I的主要优点为: 。
(4)将生成的氯气通入水中,可制得氯水,氯水见光易分解生成 气体。
(5)氯气能使湿润的红色布条褪色。对于使红色布条褪色的物质,同学们的看法不一致,认为氯水中存在的几种粒子都有可能,请利用中学实验室常见试剂,设计实验,得出正确结论。
|
提出问题 |
收集资料 |
提出假设 |
验证假设 |
得出结论 |
|
氯水中何种物质能使湿润的红色布条褪色? |
①Cl2有强氧化性 ②Cl2与冷水反应生成盐酸和HClO ③HClO有强氧化性 |
①
。 ②盐酸使布条褪色。 ③ 。 ④H2O使布条褪色 |
验证假设①:把红色干布条放入充Cl2的集气瓶,布条不褪色; 验证假设②: 。 验证假设④:把红色布条放在水里,布条不褪色。 |
使红色布条褪色的物质是 。 |
|
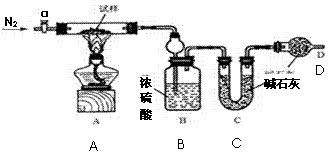
实验过程:
①按图组装仪器,检查装置的气密性;
②将试样m1g放入硬质玻璃管中,装置B、C、D中药品如图,已知加药品后装置B的质量
为m2g、装置C的质量为m3g;
③打开活塞a,通N2一段时间后,关闭活塞a,点燃酒精灯加热试样,直到B装置中无气泡冒出后,打开活塞a向装置中通入N2,一段时间后,撤掉酒精灯,关闭活塞a;
④称得装置B的质量为m4g、装置C的质量为m5g。
请回答以下问题:
(1)装置A中发生反应的化学方程式为 ,
。
(2)装置D的作用为防止空气中 进入装置C中。
装置C的作用为 。
(3)实验过程中第二次通入N2的目的是把装置中产生的 排出,使其被装置B和装置C完全吸收。
(4)用下列各项所提供的数据能计算出w(NaHCO3)的是( ) (填写序号)
|
序号 |
a |
b |
c |
d |
e |
|
数据 |
m1、m2、m3 |
m2、m3、m4、m5 |
m1、m2、m4 |
m1、m4、m5 |
m1、m3、m5 |
(5)实验结束后发现装置A中硬质玻璃管右端有水珠,你认为利用实验中所提供的数据还能否得到准确的w(NaHCO3) (填“能”或“不能”)。
18、配制一定物质的量浓度溶液是一个重要的定量实验。请回答以下问题:
(1)要配制浓度约为2 mol·L-1的NaOH溶液100mL,下列操作正确的是
A.称取8gNaOH固体,放入250mL烧杯中,用量筒量取100mL蒸馏水,加入烧杯中,同时不断搅拌至固体溶解
B.称取8gNaOH固体,放入100mL量筒中,边搅拌,边慢慢加入蒸馏水,待固体完全溶解后用蒸馏水稀释至100mL
C.称取8gNaOH固体,放入100mL容量瓶中,加入适量蒸馏水,振荡容量瓶使固体溶解,再加水至刻度线,盖好瓶塞,反复摇匀
D.用100mL量筒称取40mL 5mol·L-1的NaOH溶液,倒入250mL烧杯中,再用同一量筒量取60mL蒸馏水,不断搅拌下,慢慢倒入烧杯中
(2)下列操作使配制的BaCl2溶液浓度偏低的是
A.未洗涤烧杯和玻璃棒 B.选用的容量瓶内有少量蒸馏水
C.有少量洗涤液未能全部转移到容量瓶中
D.定容摇匀后,液面下降,又加水至刻度线
(3)某实验中需要2mol·L-1的Na2CO3溶液950mL,配制时应选用容量瓶的规格为 ,称取固体Na2CO3的质量为 。
17、下列实验操作或叙述正确的是 (填序号)
A.乙醇中含有少量水可加入生石灰再蒸馏制得无水乙醇
B.将无水乙醇和浓硫酸按体积比1∶3混合,加热至140℃制取乙烯
C.为证明溴乙烷分子中溴元素的存在,可向溴乙烷中加入NaOH溶液,加热,加入稀硝酸至溶液呈酸性,加入AgNO3溶液,看是否有淡黄色沉淀。
D.向碘水中加入酒精,萃取碘水中的碘
E.用饱和食盐水代替水与电石制备乙炔,目的是为了减缓反应速率
F.将乙烯分别通入酸性KMnO4溶液和溴水中均褪色,褪色原理相同
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com