
4.等差数列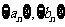 的前
的前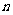 项和分别为
项和分别为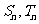 ,若
,若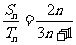 ,则
,则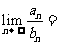 (
).
(
).
A. 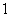 B.
B. 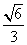 C.
C. 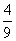 D.
D. 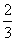
3. 函数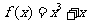 ,则
,则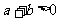 是
是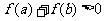 的(
)
的(
)
A.充分不必要条件 B.必要不充分条件 C.充要条件 D.既不充分也不必要条件
2.函数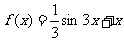 在
在 上是(
)
上是(
)
A.奇函数,增函数 B.奇函数,减函数 C.偶函数,增函数 D.偶函数,减函数
1. 某校高二学生1000人,其中文科生200人,为了了解学生某次考试情况,采用按文理分层抽样的方法,从该校高二学生中抽取一个100人的样本,则样本中文科生的人数为( )
A. 10 B. 20 C. 30 D. 40
32、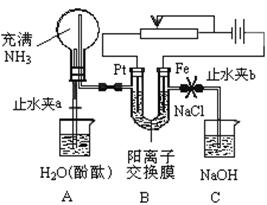 某课外活动小组设计了如图所示的装置,调节滑动变阻器,控制电流强度适中的情况下用其进行缓慢电解NaCl溶液及相关实验(此时,打开止水夹a,关闭止水夹b)。由于粗心,实验并未达到预期目的,但也看到了令人很高兴的现象(阳离子交换膜只允许阳离子和水的通过)。请帮助他们分析并回答下列问题:
某课外活动小组设计了如图所示的装置,调节滑动变阻器,控制电流强度适中的情况下用其进行缓慢电解NaCl溶液及相关实验(此时,打开止水夹a,关闭止水夹b)。由于粗心,实验并未达到预期目的,但也看到了令人很高兴的现象(阳离子交换膜只允许阳离子和水的通过)。请帮助他们分析并回答下列问题:
(1)写出B装置中的电极反应:
阴极:____________ 阳极:____________
(2)回答观察到A装置中的现象:
①_________ ;
②烧瓶中液面上升到高于左侧尖嘴一定程度后又逐渐下落至与尖嘴相平;
③________ 。
(3)当观察到A装置中的现象后,他们关闭止水夹a,打开止水夹b。再观察C装置,若无现象,说明理由,若有现象,请写出有关反应的化学方程式(是离子反应的写离子方程式):
(4)若想达到电解NaCl溶液的目的,应如何改进装置,请提出你的意见。
______________________________________________________________________。
2009-2010学年度第二学期 第二次调研考试
31、(1) 电池反应通常是放热反应,下列反应在理论上可设计成原电池的化学反应是
(填序号)。此类反应具备的条件是① 反应,② 反应。
A.C(s)+H2O(g)==CO(g)+H2(g):△H>0
B.Ba(OH)2·8H2O(s)+2NH4Cl(s)==BaCl2(aq)+2NH3·H2O( )+8H2O(
)+8H2O( )△H>0
)△H>0
C.CaC2(s)+2 H2O( )==Ca(OH)2(s)+C2H2(g);△H<0
)==Ca(OH)2(s)+C2H2(g);△H<0
D.CH4(g)+2O2(g)==CO2(g)+2H2O( ):△H<0
):△H<0
(2) 以KOH溶液为电解质溶液,依据(I)所选反应设计一个电池。其负极反应为: 。
(3) 电解原理在化学工业中有广泛的应用。现将你设计的原电池通过导线与图中电解池相连,其中a为电解液,X和Y是两块电极扳,则
①若X和Y均为惰性电极,a为饱和食盐水,则电解时检验Y电极反应产物的方法是 。
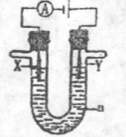 ②若X、Y分别为石墨和铁,a仍为饱和的NaCI溶液,则电解过程中生成的白色固体露置在空气中,可观察到的现象是
。
②若X、Y分别为石墨和铁,a仍为饱和的NaCI溶液,则电解过程中生成的白色固体露置在空气中,可观察到的现象是
。
③若X和Y均为惰性电极,a为一定浓度的硫酸铜溶液,通电后,发生的总反应化学方程式为 。通电一段时间后,向所得溶液中加入0.05 mol Cu(OH)2,恰好恢复电解前的浓度和PH,则电解过程中电子转移的物质的量为 mol。
(4)利用工业上离子交换膜法制烧碱的原理,用如图所示装置电解K2SO4溶液。
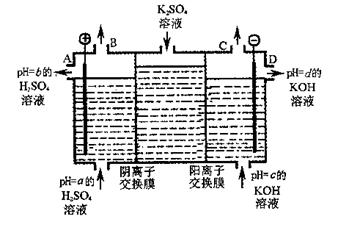 ① 该电解槽的阳极反应式为
,通过阴离子交换膜的离子数 (填“>”、“<”或“=”)通过阳离子交换膜的离子数;
① 该电解槽的阳极反应式为
,通过阴离子交换膜的离子数 (填“>”、“<”或“=”)通过阳离子交换膜的离子数;
② 图中a、b、c、d分别表示有关溶液的pH,则a、b、c、d由小到大的顺序为 ;
③ 电解一段时间后,B口与C口产生气体的质量比为 。
30、A~N均为中学化学中的常见物质,其中A是日常生活中不可缺少的物质,也是化工生产中的重要原料,单质M是目前使用量最大的金属,常温下B、E、F为气体,G为无色液体,这些物质在一定条件下存在如下转化关系,其中有些反应物或生成物已经略去。
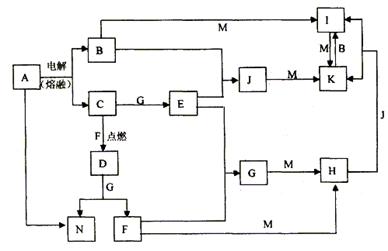
回答下列问题:
(1)H的化学式为________________________,D的电子式为_____________。
(2)工业上用A制取N反应的化学方程式为:____________________________________。
(3)I的饱和溶液滴入沸水中反应的离子方程式为:______________________ _______。
(4)G与M反应的化学方程式为_____________________________________ _______。
29、在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子称为活化分子,使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ/mol表示。请认真观察下图,然后回答问题。
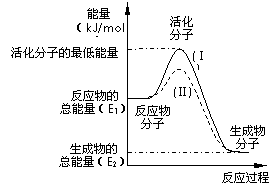
(1)图中所示反应是_________(填“吸热”或“放热”)反应,该反应________(填“需要”或“不需要”)加热,该反应的△H=___________________kJ/mol(用含E1、E2的代数式表示)。
(2)已知热化学方程式:H2(g)+ 0.5 O2(g)=H2O(g);△H=-241.8 kJ/mol
该反应的活化能为167.2 kJ/mol,则其逆反应的活化能为____________________。
(3)对于同一反应,图中虚线(Ⅱ)与实线(Ⅰ)相比,活化能大大降低,活化分子的百分数增多,反应速率加快,你认为最可能的原因是:___________________________。
28、A、B、C、D、E都是元素周期表中前20号元素,其原子序数依次增大。B、C、D同周期,A、D同主族,E和其它元素既不在同周期也不在同主族。B、C、D的最高价氧化物的水化物均能互相反应生成盐和水。A和E可形成离子化合物,其晶胞结构如下图所示:
(1)A和E所形成的化合物的电子式是
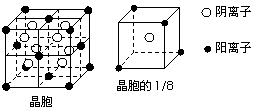 (2)A、B、C、D四种元素的原子半径由小到大的
(2)A、B、C、D四种元素的原子半径由小到大的
顺序为 (用元素符号表示)
(3)A和D的氢化物中,后者沸点较低,原因是
(4)A和E的化合物晶体中,每个阳离子的周围
与它最近且等距离的阳离子共有 个
(5)已知A和E所形成的化合物晶体的晶胞体积为1.6×10-22cm3,则A和E组成的离子化合物的密度为(结果保留一位小数) 。
27、已知反应 ①、② 是化工生产中的两个重要反应:
① 甲溶液 A + B + C
② 乙经过粉碎后在沸腾炉中燃烧,得到D和E
其中,A、D在常温常压下为刺激性气味气体,C为无色无味气体。请回答:
(1)A的电子式是 。
(2)将A通入B的溶液中,反应的离子方程式是 。
(3)1 g C在A中燃烧时放出92.3 kJ的热量,该反应的热化学方程式是 。
(4)工业上可利用E为原料冶炼其中所含的金属,方法是 。
(5)化工生产②中第二步、第三步用到的设备名称分别为 、 。第二步采用的反应条件为 。
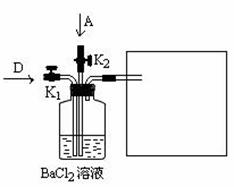 (6)将A和D按物质的量1:1通入下列装置中:
(6)将A和D按物质的量1:1通入下列装置中:
该过程中的化学方程式是 。
上述实验装置设计不完整,请将所缺部分在装置图的右边方框中画出。
(7)一定条件下,将12 g乙放入过量的的浓硝酸中,反应过程中转移1.5 mol电子,该反应的离子方程式是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com