
4.(理)设数列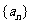 满足
满足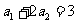 ,且对任意的
,且对任意的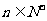 ,点
,点 都有
都有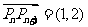 ,则
,则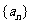 的前
的前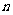 项和
项和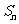 为( )
为( )
A.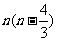 B.
B.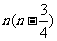 C.
C.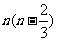 D.
D.
(文)已知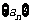 为等差数列,
为等差数列, ,
,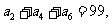 以
以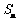 表示
表示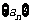 的前
的前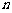 项和,则使得
项和,则使得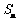 达到最大值的
达到最大值的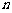 是 ( )
是 ( )
A.21 B.20 C.19 D.18
3.已知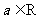 ,则“
,则“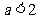 ”是“
”是“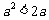 ”的 ( )
”的 ( )
A.充分不必要条件 B.必要不充分条件 C.充要条件 D.既不充分也不必要条件
2.已知A={1,2,x, 4},B={2,3,y}.且A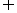 B={2,3},B集合所有子集元素的和是40.则x+y得值是(
)
B={2,3},B集合所有子集元素的和是40.则x+y得值是(
)
A.6 B. 8 C.10 D.11
一个是正确的)
1.已知集合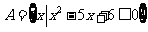 ,集合
,集合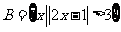 ,则集合
,则集合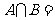 ( )
( )
(A)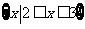 (B)
(B)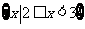
(C)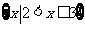 (D)
(D)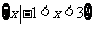
18.(21分)现有某铁碳合金,某化学兴趣小组为了测定铁碳合金中铁的质量分数,并探究浓硫酸的某些性质,设计了下图所示的实验装置和实验方案(夹持仪器已省略),请你参与此项活动并回答相应问题。(由实验装置引起的实验误差忽略不计)。
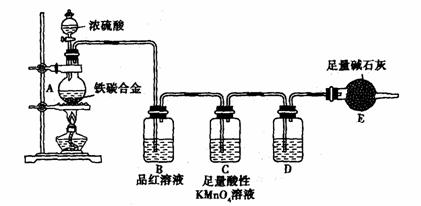
Ⅰ.探究浓硫酸的某些性质
(1) 称量E的质量;按照图示连接装置,检查装置的气密性。
(2) 将m g铁碳合金样品放入A中,再加入适量的浓硫酸。未点燃酒精灯前,A、B均无明显现象,其原因是:________________________。C中足量的酸性KMnO4溶液所起的作用
是 。D中盛放的试剂是 。
(2) 反应一段时间后,从A中逸出气体的速率仍然较快,除因反应温度较高外,还可能的原因是___________________________________________________。
 Ⅱ.测定铁的质量分数
Ⅱ.测定铁的质量分数
(4)待A中不再逸出气体时,停止加热,拆下E并称重,E增重b g,则铁碳合金中铁的质量分数为__________________________(写表达式)。某同学认为:依据此实验测得的数据,计算合金中铁的质量分数可能会偏低,你认为可能的原因是____________________________。
(5) 经过大家的讨论,决定采用下列装置和其他常用实验仪器测定某些数据即可,为了快速和准确地计算出铁的质量分数,最简便的实验操作是______________________(填写代号)。
①用排水法测定H2的体积
②反应结束后,过滤、洗涤、干燥、称量残渣的质量
③ 测定反应前后装置和药品的总质量
16.(18分)已知A、B、C、D四种短周期元素的原子序数依次增大,B的核电荷数是A、D核电荷数之和的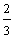 倍;A能分别与B、C、D形成电子总数相等的分子X、Y、Z。请回答下列问题:
倍;A能分别与B、C、D形成电子总数相等的分子X、Y、Z。请回答下列问题:
(1)B、D两元素的名称分别是 、 。
(2)化合物B2A2的电子式为 。
(3)Y与C的最高正价氧化物的水化物刚好完全反应时,其生成物的水溶液呈 性(填
“酸”“碱”或“中”),其原因是(用离子方程式表示) 。
(4)在(3)所得生成物的水溶液中,存在着如下关系,用粒子浓度符号填写:
① c(H+)+ =c(OH-)+ ;
② c(H+)= c(OH-)+ 。
(5)若0.2 mol液态化合物B2A8C2与液态C2D4完全反应,生成气态的C2、Z和BD2,同时放出
510 kJ热量,试写出该反应的热化学方程式:
__________________________________________________________________
(6)化合物C2A4是可燃性液体,也可用作火箭燃料。C2A4-空气燃料电池是一种碱性燃料电池,电解质溶液是20 %-30 % 的KOH溶液,放电时生成C2、Z, 则C2A4-空气燃料电池放电时,负极的电极反应式是____________ ______。
17(15分).据报道:美国海军科学家拟提取海水中溶解的二氧化碳,利用类似FT合成的方法生产短链不饱和烃,以作为汽油的替代品。研究发现,如果使用铁作催化剂,二氧化碳与氢气反应产生30%的甲烷,其余的短链烃可以被用来提炼燃料。
(1)为延缓全球温室效应,二氧化碳捕获和封存技术(CCS)是当今化学的前沿技术,下列通过化学反应捕获二氧化碳的反应,其原子利用率达100%的是 ▲ 。
(a)CO2 +CaO  CaCO3
CaCO3
(b)K2CO3+CO2+H2O=2KHCO3
(c)2Mg+CO2 2MgO+C
2MgO+C
(d)
(2)用二氧化碳合成烃,需要提供辅助原料氢气,下列制取氢气的方法可行且二氧化碳零排放的是 ▲ 。
(a)用太阳能光解海水制氢 (b)利用天然气与水高温催化制氢
(c)利用活泼金属与海水反应制氢 (d)利用核反应堆多余的电能电解海水制氢
(3)所谓FT合成,就 是CO在金属催化剂上催化氢化反应,生成以直链烷烃和烯烃为主的混合物的过程。CO2与H2合成汽油(平均组成设为C8H18)反应的化学方程式为: ▲ 。
是CO在金属催化剂上催化氢化反应,生成以直链烷烃和烯烃为主的混合物的过程。CO2与H2合成汽油(平均组成设为C8H18)反应的化学方程式为: ▲ 。
(4)某文献报道:在300℃、30MPa,以Fe、CoCl2作催化剂条件下,CO2和H2反应生成丁烷和戊烷。
①假定在一实验容器中充入一定量的CO2和H2,加入 催化剂,若CO2和H2转化率均为100%,产物只有丁烷和戊烷, n(H2)/n(CO2)=a,a取值范围为: ▲ 。
催化剂,若CO2和H2转化率均为100%,产物只有丁烷和戊烷, n(H2)/n(CO2)=a,a取值范围为: ▲ 。
②据问题①,今有标准状况下的CO2448L, n(丁烷)/n(戊烷) =x,消耗H2的物质的量为y,则y= ▲ (用x表示)。
15. (10分)盐酸、硫酸和硝酸是中学阶段常见的“三大酸”。请就“三大酸”与金属铜的反应情况,回答下列问题:
(1)在100mL 18mol/L的浓硫酸中加入过量的铜片,加热使之充分反应,产生的气体在标准状况下的体积可能是
A.40.32L B.30.24L C.20.16L D.6.72L
有同学提出,若使上述反应①中剩余的铜片继续溶解,可向其中加入硝酸钠,请判断该方案是否可行?若不可行,请说明原因。若可行,请写出反应的离子方程式 。
(2)若将过量铜粉与一定量浓硝酸反应,当反应完全停止时,共收集到的气体1.12L(标准状况),则该气体的成分是 。则反应中所消耗的硝酸的物质的量可能为
A.0.1mol B.0.15mol C.0.2mol D.0.25mol
(3)①甲同学向浸泡铜片的稀盐酸中加入H2O2后,铜片溶解,并且该反应的产物只有氯化铜和水。该反应的化学方程式为 .
13.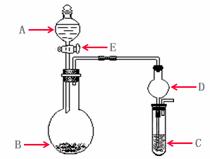
 (12分)下列几个实验可快速制取实验所需的少量气体,并进行相关性质实验。(实验装置如右图所示)
(12分)下列几个实验可快速制取实验所需的少量气体,并进行相关性质实验。(实验装置如右图所示)
 (1)若A中为
(1)若A中为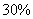 的H
的H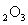 溶液,B中固体为
溶液,B中固体为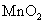 ,C中盛有
,C中盛有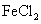 和KSCN的混合液,旋开E后,C中的现象是变红色,C中发生氧化还原反应的离子方程式是_________________________。
和KSCN的混合液,旋开E后,C中的现象是变红色,C中发生氧化还原反应的离子方程式是_________________________。
 (2)若A中浓盐酸,B中装有固体
(2)若A中浓盐酸,B中装有固体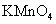 ,C中盛有KI淀粉溶液,旋开E后,B中出现哈绿色气体。已知1 mol KM
,C中盛有KI淀粉溶液,旋开E后,B中出现哈绿色气体。已知1 mol KM 发生反应时转移5mol电子,且生成的气体为单质。B中发生反应的化学方程式是________________,C中的现象是_______________________;继续反应一段时间后,发现C中溶液的颜色褪去,这是因为在溶液中_______________。
发生反应时转移5mol电子,且生成的气体为单质。B中发生反应的化学方程式是________________,C中的现象是_______________________;继续反应一段时间后,发现C中溶液的颜色褪去,这是因为在溶液中_______________。
 (3)若B中是生石灰,将A中液体逐滴加入B内,C中盛有铝盐溶液,试验中观察到C出现沉淀,最后沉淀也不溶解,A中液体名称是__________C中发生反应的离子反应方程式______________________。
(3)若B中是生石灰,将A中液体逐滴加入B内,C中盛有铝盐溶液,试验中观察到C出现沉淀,最后沉淀也不溶解,A中液体名称是__________C中发生反应的离子反应方程式______________________。 仪器D在此实验中的作用是___________________。
仪器D在此实验中的作用是___________________。
14(12分).由磷矿石、石英、氯化氢等为原料生产白炭黑(SiO2·nH2O)、磷及甲醇,下列工艺过程原料综合 利用率高,废弃物少。
利用率高,废弃物少。
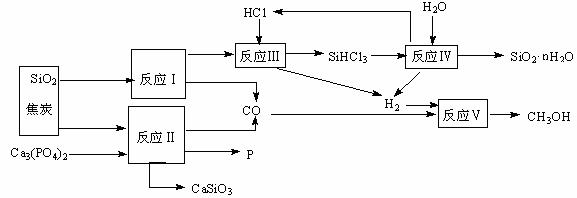
(1)上述反应中,属于置换反应的是 ▲ (选填:Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ)。
(2)已知SiHCl3的沸点为33.0℃,提纯SiHCl3适宜的方法是 ▲ 。
(3)高温下进行的反应Ⅱ的化学方程式为: ▲ ;固体废弃物CaSiO3可用于 ▲ 。
(4)反应Ⅲ需在高温、隔绝氧气和无水条件下进行,其原因是 ▲ 。
(5)CH3OH可用作燃料电池的燃料,在强酸性介质中,负极的电极反应式为 ▲ 。
12.下列离子方程式书写不正确的是
A.用醋酸溶解碳酸钙:2CH3COOH+CaCO3=2CH3COO-+Ca2++CO2↑+H2O
B.碳酸氢铵溶液中加入足量热的氢氧化钠溶液:NH4++OH-=NH3↑+H2O
C.用氯酸钠的酸性溶液与H2O2作用制取ClO2:
4ClO3-+4H2O2+4H+=4ClO2↑+3O2↑+6H2O
D.用硫酸酸化的桔红色的重铬酸钾(K2 Cr2O7)溶液与乙醇作用生成乙酸和草绿色三价铬,可用于检测是否酒后驾驶:
2Cr2O72-+ 3C2H5OH + 16H+ → 4Cr3+ + 3CH3COOH + 11H2O
第Ⅱ卷(非选择题 共78分)
11. 洋蓟素是一种新结构类型的抗乙型肝炎病毒和抗艾滋病病毒的化合物,其结构如
洋蓟素是一种新结构类型的抗乙型肝炎病毒和抗艾滋病病毒的化合物,其结构如 下图所示,有关洋蓟素的说法正确的是
下图所示,有关洋蓟素的说法正确的是
A.分子中含有4个手性碳原子
B.不能与氯化铁溶液发生显色反应
C.一定条件下能发生酯化反应和消去反应
D.1mol洋蓟素最多可与11molNaOH反应
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com