
36.(8分)燃料电池具有广阔的发展前途,科学家近年研制出一种微型的燃料电池,采用甲醇取代氢气做燃料可以简化电池设计,该电池有望取代传统电池。某学生在实验室利用碱性甲醇燃料电池电解Na2SO4溶液。

请根据图示回答下列问题:
(1)图中a电极是 (填“正极”、“负极”、“阴极”或“阳极”)。该电极上发生的电极反应式为 。
(2)碱性条件下,通入甲醇的一极发生的电极反应式为 。
(3)当消耗3.36 L 氧气时(已折合为标准状况),理论上电解Na2SO4溶液生成气体的总物质的量是 mol。
(4)25℃、101kPa时,燃烧16g甲醇生成CO2和H2O(l),放出的热量为363.26 kJ,写出甲醇燃烧的热化学方程式: 。
2009-2010学年度下学期 期末考试
35.(13分)(1)某学生判断SO2和Na2O2反应能生成硫酸钠,你认为他的判断合理吗?
简要说明你的理由: 。
(2)该同学无法断定SO2和Na2O2反应中是否有氧气生成,拟使用下列装置进行实验

装置中B中的试剂为 ,其作用是
D中的 药品为
,其作用是
药品为
,其作用是
(3)为确认SO2和Na2O2反应产物,该同学设计了以下实验步骤,你认为应进行的操作按顺序排列是(填序号)
A.用带火星的细朩条靠近U形管口,观察细朩条是否着火燃烧
B.将C装置中反应后的固体物质溶于适量水配成溶液
C.在配成的溶液中加入用硝酸酸化的硝酸钡溶液,观察是否有沉淀生成
D.在配成的溶液中先加入盐酸酸化,再加入氯化钡溶液,观察是否有气泡或沉淀生成
34.(17分)将羧酸的碱金属盐电解可得到烃类化合物。例如:
2CH3COOK+2H2O CH3-CH3+2CO2↑+H2↑+2KOH
CH3-CH3+2CO2↑+H2↑+2KOH
 请根据下列表示的衍变关系,回答问题。
请根据下列表示的衍变关系,回答问题。
(1)写出下列物质的结构简式A:  E:
I
E:
I
(2)G能发生反应的类型有(填序号):
a.取代 b.加成 c.还原 d.氧化 e.消去 f.水解
(3)写出H的最简单的两种同系物的结构简式 , 。
(4)F与J的关系为  (填序号) a.同一物质 b.同系物 c.同分异构体 d.同素异形体
(填序号) a.同一物质 b.同系物 c.同分异构体 d.同素异形体
(5)写出下列过程的化学方程式:
C→D: C+E→F :
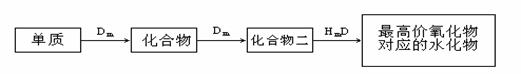
33.(10分)A、B、C、D、E是位于短周期的主族元素,其中A、B为金属元素。已知:①热稳定性:HmD>HmC;②Cm-、E(m-1)-具有相同的电子层结构;③B与E在同一周期,在该周期中,E的原子半径最小,B的离子半径最小; ④A、B所形成的单核离子具有相同的电子层结构,B的最高价氧化物对应的水化物与A、E的最高价氧化物对应的水化物都能反应。依据上述信息回答下列问题:
④A、B所形成的单核离子具有相同的电子层结构,B的最高价氧化物对应的水化物与A、E的最高价氧化物对应的水化物都能反应。依据上述信息回答下列问题:
(1)HmD的电子式:___________________。
(2)Cm-、E(m-1)-的还原性强弱为___________>___________(填离子符号),能证明其
还原性强弱的离子方程式为 。
(3)写出B的最高价氧化物对应的水化物和A的最高价氧化物对应的水化物反应的离子方程式_________________________________________________________。
(4)在B、C、E单质中,符合下列转化关系的是___________。(填元素符号)
32.(6分)有下列转化关系: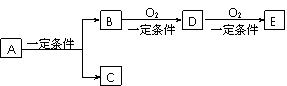
(1)若C是可用于自来水消毒的气体,A生成的B的反应为工业上冶炼金属B的反应,反应条件为电解,D、E是氧化物,D转化为E 时增加氧的质量是总质量的25.8%,则写出A在一定条件下生成的C方程式
时增加氧的质量是总质量的25.8%,则写出A在一定条件下生成的C方程式
 , E的电子式为
, E的电子式为
(2)若E是酸酐,且为无色易挥发的晶体,A为气态氢化物,则A与D反应生成B的化学方程式为 。
31.(6分)填空:
(1)在测定硫酸铜结晶水含量实验过程中,称量操作至少进行 次。当加热到
时,停止加热,并将坩埚放在
中冷却。当
时则可认为结晶水已经完全失去。实际操作中,有些操作会使实验结果偏高或偏低。下 列操作会使测定结果偏高的是 (填字母)
列操作会使测定结果偏高的是 (填字母)
A.加热温度过高而使硫酸铜部分分解 B.坩埚用水洗后没有烘干
C.加热后放在空气中冷却 D.粉末未完全变白就停止加热
(2)同素异形体相互转化的反应热相当小而且转化速度较慢,有时还很不完全,测定反应热很困难。现在可根据盖斯提出的观点“不管化学过程是一步完成或分几步完成,这个总过程的热效应是相同的”来研究。已知: P4(s、白磷)+5O2(g)=P4O10(s);△H= -2983.2kJ·mol-1 P(s、红磷)+5/4O2
-2983.2kJ·mol-1 P(s、红磷)+5/4O2 (g)=1/4P4O10(s);△H=-738.5kJ·mol-1
(g)=1/4P4O10(s);△H=-738.5kJ·mol-1
由此可知白磷的稳定性比红磷_____。(填写“强”或“弱 ”)
30.下列叙述正确的是 ( )
A.在原电池的负极和电解池的阴极上都是发生氧化反应
B.铝比铁活泼,但铝制品比铁制品在空气中耐腐蚀
 C.用惰性电极电解饱和NaCl溶液,若有2mol电子转移,则生
C.用惰性电极电解饱和NaCl溶液,若有2mol电子转移,则生 成1molNaOH
成1molNaOH
D.用惰性电极电解Na2SO4溶液 ,阴阳两极产物的物质的量之比为1:2
,阴阳两极产物的物质的量之比为1:2
第Ⅱ卷(非选择题 共60分)
29. 如下图所示,X、Y、Q、W都是惰性电极,将电源接通后,W极附近颜色逐渐加深。下列说法中不正确的是( )
如下图所示,X、Y、Q、W都是惰性电极,将电源接通后,W极附近颜色逐渐加深。下列说法中不正确的是( )
A.电源的M极为正极
B.甲装置中溶液的PH减小
C.甲装置的两个电极上都有单质生成且物质的量之比
为1:1
D.欲用乙装置给铜镀银,U极应该是Ag,电镀液选择AgNO3溶液
28.设NA表示阿伏加德罗常数,下列说法中正确的是( )
A.1mol甲基正离子(CH3+)所含电子数为8NA
B.NA个H2分子的质量约为2g,它所占的体积约为22.4L
C.标准状况下,11.2LCHCl3中所含的分子数为0.5N
D.500mL 0.5mol/L的Ca(ClO)2溶液中,含有ClO-的数目为0.5N
27.下列“黄色”不属于因化学反应而产生的是( )
A.硫置于水中,沉淀物质呈黄色 B.久置的碘化钾溶液呈黄色
C.久置的浓硝酸呈黄色 D.鸡蛋白溶液遇浓硝酸呈黄色
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com