
24.(1) ;
(2)
(3) ; ; ;
23.(1)
(2) ;_____________________________________________________;
__________________________________________________________________
22.(1)_____________________
(2)________________ ;____________________________________________________
(3) ;___________
21.______________________
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
|
|
|
|
|
|
|
|
|
|
|
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
19 |
20 |
|
|
|
|
|
|
|
|
|
|
|
26.(14分)已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于前三周期。A元素不与B、C、D三种元素同周期,且原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍。A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体;A、B二种元素组成的原子个数比为1︰1的化合物N是常见的有机溶剂。E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同。
请回答下列问题:(答题过程中涉及到A、B、C、D、E元素时,用所对应的元素符号表示)
(1)B、C、D三种元素的第一电离能由小到大的顺序为___________________;BD2的结构式为___________________;A3D+离子的VSEPR模型为___________________;B、C的气态氢化物分子中,键角的大小关系为B_____C(填“>、= 或 <”)。
(2)E元素在元素周期表分区中属于_______区元素,该元素基态原子的外围电子排布式为 。
(3)下列叙述正确的是 。(填字母)
A.A元素位于元素周期表的s区,且在元素周期表的所有元素中电负性最小
B.M和N分子中的B原子均采用sp2杂化
C.N分子中含有6个σ键和1个π键
D.BA4为最简单的有机物
(4)某离子化合物R的化学式为CA5 ,它的所有原子的最外层都符合相应的稀有气体原子的最外层电子结构,则R的电子式为____________。
(5)在浓的ECl3的盐酸溶液中加入乙醚,并通入HCl至饱和,可得到配位数为6 ,组成为ECl3·6H2O的绿色晶体,该晶体中两种配体的物质的量之比为1︰5,则该配离子的化学式为 。

|
牡一中2009-2010学年下学期期末考试高二学年
化学学科试题答题卡
25.(15分)为扩大现有资源的使用效率,在一些油品中加入降凝剂J,以降低其凝固点,从而扩大燃料油品的使用范围。下面是J的合成路线及L的性质图示:
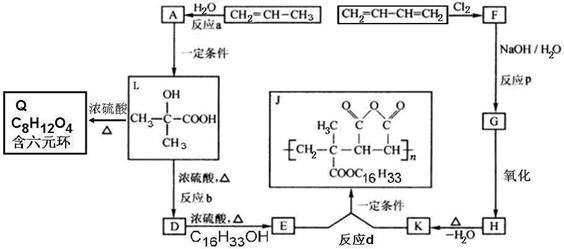
试回答下列问题:
(1)分别写出反应b和d的反应类型:b______________;d______________。
(2)分别写出E和H结构简式:E__________________;H__________________。
(3)写出化学方程式:F→G______________________;L→Q______________________。
(4)L在一定条件下可以生成一种高分子化合物M,写出此反应的化学方程式:_________________________________________________。
(5)D的同分异构体中,能使Br2的CCl4溶液褪色,并能发生水解反应和银镜反应的有__________种,其中在核磁共振氢谱中出现四组峰,且峰面积之比为2:2:1:1的是______________________(写出结构简式)。
24.(10分)三氟化氮是一种无色、无味、无毒且不可燃的气体,在半导体加工,太阳能电池和液晶显示器的制造中得到广泛应用。NF3可在铜的催化作用下由F2和过量NH3反应得到。
(1)氟元素基态原子的价电子排布图为 ;NF3中心原子轨道的杂化类型为 。
(2)写出制备NF3的化学方程式: 。
(3)理论上HF、NaAlO2和NaCl按6 : 1 : 2的物质的量之比恰好反应生成HCl、H2O和一种微溶于水的重要原料,该物质含有三种元素,在金属铝的冶炼中有重要作用。该物质为配合物,其中心离子是 ,配位数为 。该化合物焰色反应火焰呈现___________色。很多金属盐都可以发生焰色反应,其原因是________________________________________________________。
23.(9分)某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液。请回答:
(1)浓硫酸的作用是 。
(2)球形干燥管C的作用是 。若反应前向D中加入几滴酚酞,溶液呈红色,产生此现象的原因是 ;反应结束后D中的现象是 。
22.(9分)等电子体具有相似的电子结构、几何构型和性质。
(1)SO2、O3、NO2-三种粒子是等电子体,此三种粒子的立体构型为__________。
(2)C2O42-和 (分子)是等电子体,C2O42-离子具有较强的还原性,它能使酸性KMnO4溶液褪色,写出此反应的离子方程式:
(3)由双原子构成,总电子数为14的等电子体共同特点是物质中都具有共价三键,请举出相应的3个例 子
(分子或离子)。每个分子或离子中含______个π键。
子
(分子或离子)。每个分子或离子中含______个π键。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com