
3.若关于x的方程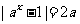
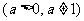 有两个不等实根,则
有两个不等实根,则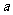 的取值范围是( )
的取值范围是( )
A. B.
B.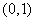 C.
C. D.
D.
2.“p或q是假命题”是“非p为真命题”的 ( )
A.充分不必要条件 B.必要不充分条件
C.充要条件 D.既不充分又不必要条件
1.设复数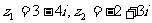 ,则
,则 在复平面内对应的点位于 ( )
在复平面内对应的点位于 ( )
A.第一象限 B.第二象限
C.第三象限 D.第四象限
17.(8分) 食品安全关系国计民生,影响食品安全的因素很多。下面是以食品为主题的相关问题,请根据要求回答。
(1)人们从食用植物油中摄取的亚油酸对人体健康是十分有益的,但是市场经常出现价格低廉的劣质植物油,其中亚油酸的含量很低。下列关于亚油酸的说法中,正确的是
提示:亚油酸的结构简式为CH3(CH2)4CH=CHCH2CH=CH(CH2)7COOH
A.在食用油中亚油酸通常是以甘油酯的形式存在
B.亚油酸是一种高级饱和脂肪酸
C.亚油酸含量高的食用油在空气中易变质氧化
D.亚油酸与甘油可发生酯化反应,生成的油脂是一种纯净物
(2) 酒精在人体肝脏内可转化为多种有害物质,有机物A是其中一种。经分析测得:A的相对分子质量为60,分子中碳氢两元素的质量分数之和为46.4%,其余为氧元素,A的水溶液pH<7。请写出A的结构简式:

(3) 聚偏二氯乙烯( )具有超强阻隔性能,可作为保鲜食品的包装材料。
它是由 (写结构简式)发生加聚反应生成的。若以CH≡CH为原料,通过加成反应1,1,2-三氯乙烷,再和NaOH溶液反应可合成这种单体。则上述加成反应中宜选择的加成试剂是
A.HCl B.Cl2 C.HClO D.NaCl
选考题(第18-1、18-2题为《有机化学基础》模块题,第19-1、19-2题为《物质结构与性质》模块题,第20-1、20-2题为《化学与技术》模块题。考生只能从三个模块中任选一个作答,不得跨模块答题,否则只能以所答的第一个模块计分。答题前,请用2 B铅笔在答题卡上把所选模块对应的标号涂黑。注意所做模块题必须与所涂模块相同。)
《有机化学基础》
18-1.(6分,该题为多项选择题,全选对得6分,漏选按比例给分,错选或多选为0分)
洋蓟素是一种新结构类型的抗乙型肝炎病毒和抗艾滋病病毒的化合物,其结构如下图所示,有关洋蓟素的说法正确的是 ( )
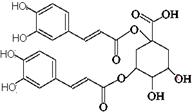 A.与氯化铁溶液发生显色反应
A.与氯化铁溶液发生显色反应
B.一定条件下能发生酯化反应和消去反应
C.发生水解反应,水解后生成两种物质
D.1mol洋蓟素最多可与11molNaOH反应
E.1mol洋蓟素最多可与5molBr2反应
18-2.(14分)某有机物J(C19H20O4)不溶于水,毒性低,与聚氯乙烯、聚乙烯等树脂具有良好相容性,是塑料工业主要增塑剂,可以用下列方法合成之:
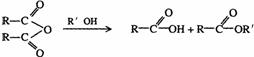
已知:
 合成路线:
合成路线:
上述流程中:(ⅰ)反应 A→B仅发生中和反应,(ⅱ)F与浓溴水混合不产生白色沉淀。
(1)指出反应类型:反应② 反应④ 。
(2)写出结构简式:Y F 。
(3)写出B+E→J的化学方程式 。
(4)写出E的属于芳香烃衍生物的同分异构体的结构简式: 、 。
《物质结构与性质》
19-1.(6分,该题为多项选择题,全选对得6分,漏选按比例给分,错选或多选为0分)
下列说法正确的是 ( )
A.NH3和H2O的中心原子都是SP3杂化
B.随着核电荷数的递增,同主族元素的单质熔点不断升高
C.苯和乙烷的蒸发时破坏的作用力是一样的
D.金刚石和石墨都属于原子晶体
E.在晶体中只要有阴离子就一定有阳离子
19-2.(14分)
 A、B、C、D、E、F为原子序数依次增大的短周期主族元素。
A、B、C、D、E、F为原子序数依次增大的短周期主族元素。
A、F原子的最外层电子数均等于其周期序数,F原子的电子
层数是A的3倍;B原子核外电子分处3个不同能级,且每个
能级上排布的电子数相同;A与C形成的最简单分子为三角锥
形;D原子p轨道上成对电子数等于未成对电子数;E原子核
外每个原子轨道上的电子都已成对,E电负性小于F。
⑴ 写出B的基态原子的核外电子排布式 。
⑵ A、C形成的最简单分子极易溶于水,其主要原因是 ;与该最简单分子互为等电子体的阳离子为 。
⑶ 比较E、F的第一电离能:E F(选填“>”或“<”=。
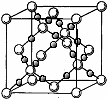
⑷ BD2在高温高压下所形成的晶胞如右图所示。该晶体的类型属于(选填“分子”、“原子”、“离子”或“金属”)晶体,该晶体中B原子的杂化形式为 。
⑸光谱证实单质F与强碱性溶液反应有[F(OH)4]-生成,则[F(OH)4]-中存在 。
a.共价键 b.非极性键 c.配位键 d.σ键 e.π键
《化学与技术》
20-1.(6分,该题为多项选择题,全选对得6分,漏选按比例给分,错选或多选为0分)
为全面推动国际旅游岛建设,大力发展绿色产业,保护和改善自然环境,据此下列各项措施符合海南省发展方向的是: ( )
A.发展水电核电,充分利用太阳能、风能、潮汐能发电以减少火力发电带来的二氧化硫和二氧化碳排放问题
B.发展低碳经济、循环经济、积极推行“限塑令”,加快研发利用二氧化碳合成的聚碳酸酯类可降解塑料
C.依托南海资源,大力发展石油化工产业,打破传统的产业结构
D.加速建设城际轻轨,发展改善城市公交系统,减少汽车尾气排放
E.推行垃圾分类,对未经分类的生活垃圾和工业垃圾使用填埋法处理
20-2.(14分)
工业上电解制碱的技术是用离子交换膜法,主要原料是饱和食盐水。
请回答下列问题:
电解槽中部的阳离子交换膜把电解槽隔成了阴极室和阳极室,
它只允许 (填离子符号,下同)通过,
而不允许 和气体通过。
电解法制碱的主要原料饱和食盐水是由粗盐制得,其中含有泥沙
及Ca2+、 Mg2+ 、Fe3+、 SO42-等杂质,因此必须精制。
精制时所用试剂为① NaOH ② Na2CO3 ③ BaCl2④ 盐酸,
这四种试剂的添加顺序为 (填序号)。
氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上。在这种工艺设计中,相关物料的传输与转化关系如下图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过。

① 图中X、Y分别是 、 (填化学式),分析比较图示中氢氧化钠
质量分数 a%与b%的大小 ;
②分别写出燃料电池B中正极、负极上发生的电极反应正极: ; 负极: ;
③这样设计的主要节(电)能之处在于(写出2处) 、 。
16.(9分)某同学根据Mg与CO2反应原理,推测钠也应能在CO2中燃烧。为了确定其生成产物并进行实验论证,请你参与以下研究过程。该同学按实验要求,用下列装置进行实验(已知PdCl2溶液能被CO还原得到黑色的Pd),请完成下列问题:
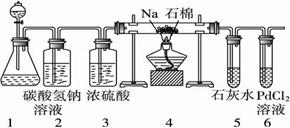
(1)装置1中玻璃仪器的名称是 , ;装置2的作用是 。
(2)若装置6中有黑色沉淀,装置4中的残留固体(只有一种物质)加盐酸有能使石灰水变浑浊的气体放出,则钠与二氧化碳反应的化学方程式为: ;
(3)若装置6中溶液无明显现象,装置4中残留固体(有两种物质)加盐酸有能使石灰水变浑浊的气体放出,则钠与二氧化碳反应的化学方程式为:___ ;
(4)指导老师认为,不仅要检验残留固体中是否有碳酸钠还要检验其中是否有氧化钠和碳,当确认钠充分反应后,请你设计一个简单实验,验证装置4中得到的残留固体中是否含有碳: 。
15.(9分)
(1)体积相同,浓度均为0.2 mol/L的盐酸和CH3COOH溶液,分别加水稀释10倍,溶液的pH分别变成m和n,则m与n的关系为______________,稀释后两溶液中和NaOH溶液的能力 。
(2)体积相同,pH均等于3的盐酸和CH3COOH溶液,分别加入等浓度的NaHCO3的溶液,开始时放出二氧化碳的速率盐酸_________醋酸(填“大于”“等于”“小于”)
(3)常温下,将pH=2的盐酸和pH=12的氨水等体积混合,混合后溶液的pH_____ 7(填“大于”“等于”“小于”)。并解释你所填选项的理由
(4)如何证明醋酸是弱酸? 。
13.(8分) A、B、C、D、E、F六种物质的相互转化关系如下图所示(反应条件未标出),其中反应①是置换反应,A是常见的金属单质,D是无色气体单质、F是黄绿色气态单质,反应①②均在水溶液中进行的。

(1)写出B的电子式 ,
(2) 写出反应①的化学方程式 ;
(3)E的水溶液显酸性其原因是(用离子方程式表示)____________________;
(4)已知3gD和足量F反应放出a kJ的热量,请写出表示过程④的热化学方程式
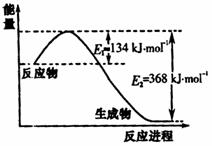 14.(10分)碳、氮元素及其化合物与人类的生产生活密切相关。试回答下列有关问题:
14.(10分)碳、氮元素及其化合物与人类的生产生活密切相关。试回答下列有关问题:
(1)右图是1molNO2和1molCO反
应生成CO2和NO过程中能量
变化示意图,请写出NO2和CO
反应的热化学方程式
。
(2)NH3极易溶于水,其水溶液俗称氨水。
用水稀释0.1mol·L-1的氨水,溶液中
随着水量的增加而减小的是 (填序号)。
 A.
A. B.
B.
C.c(H+)·c(OH-) D.
(3)标准状况下,将1.12LCO2通入100mL 1mol·L-1的NaOH溶液中,所得溶液中离子浓度由大到小的顺序为 ;
(4)在固定体积的密闭容器中,进行如下化学反应:

 N2(g)+3H2(g) 2NH3(g)。
N2(g)+3H2(g) 2NH3(g)。
当反应达到平衡时不断改变条件(不改
变N2、H2和NH3的量),右图表示反应
速率与反应过程的关系,其中表示平
衡混合物中NH3的含量最高的一段时间
是 。
(5)甲烷燃料电池中发生的化学反应为:CH4+2O2=CO2+2H2O,该电池的电解质溶液为H2SO4溶液,写出其负极的电极反应式 。
12.在一定条件下,使CO和O2的混合气体26g充分反应,所得混合物在常温下跟足量的Na2O2固体反应,结果固体增重14g,则原混合气体中CO和O2的质量比可能是( )
A.9:4 B.1:1 C.7:6 D.6:7
第Ⅱ卷(共64分)
11.氯原子对O3分解有催化作用:Cl+O3=ClO+O2
ΔH1;ClO+O=Cl+O2 ΔH2大气臭氧层的分解
反应是:O+O3=2O2 ΔH,该反应的能量变化
示意图如下:下列叙述中,正确的是( )
A.反应O+O3=2O2的 ΔH=E1-E3 B.O+O3=2O2是放热反应
C.ΔH=ΔH1 +ΔH2 D.大气层中的臭氧无法再生
10.能够充分说明在恒温下的密闭恒容容器中反应:2SO2+O2 2SO3,已经达到平衡的标志是 ( )
2SO3,已经达到平衡的标志是 ( )
A.容器中SO2、O2、SO3共存
B.容器中气体的密度不再改变
C.容器中SO2、O2、SO3的物质的量比为2︰1︰2
 D.容器中压强不随时间的变化而改变
D.容器中压强不随时间的变化而改变
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com