
4.若α、β的终边关于y轴对称,则下列等式正确的是( )
A.sinα=sinβ B.cosα=cosβ C.tanα=tanβ D.tanα·tanβ=1
3、已知函数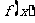 是R上的偶函数,且在区间
是R上的偶函数,且在区间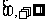 上是增函数.令
上是增函数.令
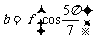
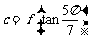 ,则
( )
,则
( )
A.  B.
B. 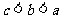 C.
C. 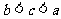 D.
D. 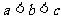
2. 的值是( )
的值是( )
A. B.
B. C.
C. D.
D.
1.手表时针走过2小时,时针转过的角度为( )
A.60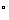 B.-60
B.-60 C. 30
C. 30 D. -30
D. -30
25.某元素的同位素AZX,它的氯化物XCl2 1.11g溶于水制成溶液后, 加入1mol/L的AgNO3溶液20mL恰好完全反应。若这种同位素原子核内有20个中子,则:
(1) Z的值为 和A的值为 ;
(2)X元素在周期表中的位置 。
山东莘县实验高中09-10学年高一下学期4月月考
24.动手实践:某同学做同周期元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象(见下表,表中的“实验方案”与“实验现象”前后不一定是对应关系)。
|
实验步骤 |
实验现象 |
|
①将镁条用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾;再向溶液中滴加酚酞溶液 |
A.浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色。 |
|
②向新制得的Na2S溶液中满加新制的氯水 |
B.有气体产生,溶液变成浅红色 |
|
③将一小块金属钠放入滴有酚酞溶液的冷水中 |
C.剧烈反应,迅速产生大量无色气体. |
|
④将镁条投入稀盐酸中 |
D.反应不十分剧烈;产生无色气体。 |
|
⑤将铝条投入稀盐酸中 |
E.生成白色胶状沉淀,继而沉淀消失 |
|
⑥向A1Cl3溶液中滴加NaOH溶液至过量 |
F.生成淡黄色沉锭。 |
请你帮助该同学整理并完成实验报告。
(1)实验目的:研究 元素性质递变规律。
(2)实验用品:
试剂:金属钠,镁条,铝条,稀盐酸,新制氯水,新制Na2S溶液,AlC13溶液,NaOH溶液,酚酞溶液等。
仪器:① ,② ,③ ,胶头滴管,镊子,小刀,玻璃片,砂纸,火柴等。
(3)实验内容:(填写与实验步骤对应的实验现象的编号和②⑤的化学方程式)
|
实验内容 |
① |
② |
③ |
④ |
⑤ |
⑥ |
|
实验现象(填A~F) |
B |
F |
|
|
|
|
② ,⑤ ,
(4)实验结论: ,
。
23.有A、B、C、D四种元素:A元素的两原子间以三对共用电子对形成气态物质,B元素原子核外有三个电子层,它是同一周期所有元素中最易失去电子的,C和B同周期,0.1mol的C与足量盐酸反应生成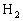 (标准状况下)3.36L,D的单质与
(标准状况下)3.36L,D的单质与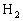 在冷暗处相遇即发生爆炸而化合。请回答:
在冷暗处相遇即发生爆炸而化合。请回答:
(1)A的气态氢化物的结构式为____________________。
(2)B的单质与水反应的离子方程式为________________________________
(3)C的最高价氧化物是_______________(离子化合物或共价化合物)
判断的依据是
与氢氧化钠溶液反应的离子方程式为________________________________ _
(4)D的单质与水反应的化学方程式
22.(11分)表1是元素周期表的一部分
表1部分元素周期表
|
族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
O |
|
1 |
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
D |
|
|
3 |
B |
|
C |
|
|
|
|
E |
|
4 |
|
A |
|
|
|
|
|
|
⑴ 写出元素符号: C 、E ;
⑵ D- 离子结构示意图 ,B+ 离子结构示意图 ,
⑶ 用电子表示化合物AD2的形成过程 ,
D元素氢化物电子式 。
21.(4分)在NaCl、NaOH、N2、H2S中,只含有离子键的是 ,只含有极性键的是 ,只含有非极性键的是 ,既含有离子键又有极性键的是 。
20.可能存在的第119号元素,有人称“类钫”,据周期表结构及元素性质变化趋势,有关“类钫”的预测说法正确的是:
A.“类钫”在化合物中呈+1价; B.“类钫”属过渡元素,具有放射性;
C.“类钫”单质的密度小于1g/cm3; D.“类钫”单质有较高的熔点。
第Ⅱ卷(共45分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com