
23.(10分)1 L某混合溶液,可能含有的离子如下表:
|
可能大量含有的阳离子 |
H+、K+、Mg2+、Al3+、NH4+、Fe2+、Fe3+ |
|
可能大量含有的阴离子 |
Cl-、Br-、I-、CO32-、AlO2- |
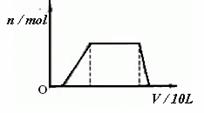
(1)往该溶液中逐滴加入NaOH溶液,产生沉淀的物质的量(n)与加入NaOH溶液的体积(V)的关系如下图所示。则该溶液中确定含有的离子是____________________,一定不含有的阳离子是 ,一定不存在的阴离子是 。
(2)经检测,该溶液中还含有大量的Cl-、Br-、I-,若向1 L该混合溶液中通入一定量的Cl2 ,溶液中Cl-、Br-、I-的物质的量与通入Cl2的体积(标准状况)的关系如下表所示,分析后回答下列问题:
|
Cl2的体积(标准状况) |
2.8 L |
5.6 L |
11.2 L |
|
n(Cl-) |
1.25 mol |
1.5 mol |
2 mol |
|
n(Br-) |
1.5 mol |
1.4 mol |
0.9 mol |
|
n(I-) |
a mol |
0 |
0 |
①当通入Cl2 的体积为2.8 L时,溶液中发生反应的离子方程式为
______ ______。
②原溶液中Cl-、Br-、I-的物质的量浓度之比为__________________。
6.38%。不法分子通过在低蛋白含量的奶粉中加入三聚氰胺来“提高”奶粉中的蛋白质含量,导致许多婴幼儿肾结石。
已知三聚氰胺的分子式是C3H6N6,即含氮量为66.7%。假定奶粉中蛋白质含量为
16%即为合格,不法分子在一罐总质量500g、蛋白质含量为0的假奶粉中掺入 g的三聚氰胺就可使奶粉“达标”。
|
2 mol X、2 molY,起始时,VA= a L,VB= 0.8 a L(连通管的体积忽略不计),在相同温度和有催化剂存在的条件下,两容器中各自发生下述反应:3X(g)+3Y(g) 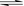 2Z(g)+2W(g),达到平衡时,VB=0.6 a L。
2Z(g)+2W(g),达到平衡时,VB=0.6 a L。

(3)平衡时A、B中混合气体的平均相对分子质量的关系是:MA _____MB(填“>”“=”“<”)。
(4)如果要计算出平衡时B中混合气体的密度,则至少还需要知道的数据是_____
(MX、MY、MZ、MW分别表示X、Y、Z、W的摩尔质量)。
①MX ②MY ③MZ ④MW
A.③和④ B.①和② C.①和③ D.②③④
(5)打开K,一段时间后反应再次达到平衡,则B的体积为________L。
21.(7分)蛋白质是一类复杂的含氮化合物,每种蛋白质都有其恒定的含氮量[约在
14%~18%(本题涉及的含量均为质量分数)],故食品中蛋白质的含量测定常用凯氏定氮法。其测定原理是:
 Ⅰ.蛋白质中的氮(用氨基表示)在强热和CuSO4、浓H2SO4 作用下,生成一种无机含氮化合物,反应式为:
Ⅰ.蛋白质中的氮(用氨基表示)在强热和CuSO4、浓H2SO4 作用下,生成一种无机含氮化合物,反应式为:
 2NH2- + H2SO4 + 2H+
2NH2- + H2SO4 + 2H+
Ⅱ.该无机化合物在凯氏定氮器中与碱作用,通过蒸馏释放出NH3,收集于H3BO3 溶液中,生成(NH4)2B4O7。
Ⅲ.用已知浓度的HCl标准溶液滴定,根据HCl消耗的量计算出氮的含量,然后乘以相应的换算系数,即得蛋白质的含量。
(1)上述原理第Ⅰ步生成的无机含氮化合物化学式为 。
(2)上述原理第Ⅱ步有关反应的离子方程式为:
, 。
(3)乳制品的换算系数为6.38,即若检测出氮的含量为1%,蛋白质的含量则为
20.(10分)乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物。

回答下列问题:
(1)正四面体烷的二氯取代产物有 种。
(2)关于乙烯基乙炔分子的说法错误的是 (填字母符号)。
A.能使酸性KMnO4溶液褪色
B.1 mol乙烯基乙炔能与3 mol Br2发生加成反应
C.乙烯基乙炔分子内含有两种官能团
D.等质量的乙炔与乙烯基乙炔完全燃烧时的耗氧量不相同
E.乙烯基乙炔分子中的所有原子一定都共平面
(3)写出与环辛四烯互为同分异构体且属于芳香烃的分子的结构简式 。
(4)下列属于苯的同系物的是 (填字母符号)
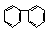


 A.
B.
C. D.
A.
B.
C. D.
(5)写出乙醛与银氨溶液发生反应的化学方程式:
。
19.(18分)现有A、B、C、D、F六种短周期元素,在化学反应中均能形成简单的阴离
子或阳离子,且A、B、C、D离子具有相同的电子层结构。
已知:①常温下,F的单质是一种有色气体,常用于杀菌、消毒;
②A的单质可以溶于NaOH溶液,向生成的溶液中通入CO2气体有白色沉淀生成;
③C的氢化物分子G是具有10电子的微粒,且可以发生下列转化:
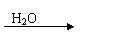


G P Q M + P
④E和D是同一主族的元素,二者能形成微粒的个数比为1︰2和1︰3的化合物T
和K;
⑤B和D可形成微粒个数比为1︰1和2︰1的离子化合物X和Y。
请回答下列问题:
(1)B元素的名称是 ;E元素的原子结构示意图是 。
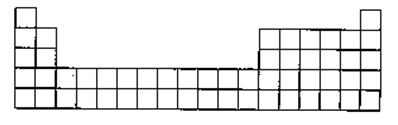 (2)请将A、C的元素符号填在如图所示部分元素周期表的适当位置上。
(2)请将A、C的元素符号填在如图所示部分元素周期表的适当位置上。
(3)G的电子式为 ,化合物X所含化学键类型有 。
(4)D的氢化物与E的氢化物比较,沸点较高的是 (填化学式),其主
要原因是 。
(5)T与F单质的水溶液反应的离子方程式为 ;
G与D的单质反应的化学方程式为 ;
M与铜反应的化学方程式为 。
18.25oC,pH=a的氨水与pH=b的盐酸等体积混合,恰好完全反应。已知此氨水的密度为0.90 g · cm-3,则该氨水的质量分数为
A. B.
B. C.
C. D.
D.
成都七中2008-2009学年上期高2009级
期中考试化学试卷
Ⅱ卷 (共56分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com