
4、翻开美国历史,共有九位总统曾在众议院被提案弹劾。他们是泰勒、强森、克里夫兰、胡佛、杜鲁门、尼克松、里根、老布什和克林顿,民主党和共和党领袖都未能幸免。这充分体现了
A、分权制衡的原则 B、法律至上 C、两党政治 D、联邦制
3、美国总统奥巴马在国会发表演说解释2009年庞大的军费开支,形成这种局面的原因
A、总统对议会负责 B、议会掌握立法权
C、军费数量太大,引起整个世界的不满 D、议会掌握联邦财政
2、以下对雅典和古罗马民主政治的表述,不正确的是
A、所谓的民主是为解决平民与贵族的矛盾而产生的
B、伯里克利时期,雅典的民主政治发展到鼎盛阶段
C、在雅典和罗马人人都可审议并决定一切国家大事
D、罗马法的核心内容之一是承认财产神圣不可侵犯
1、钱穆认为“周部族融入,把中国文化规模摆出,大体确定,后来虽有不断的吸引融合,但我们已有了一个重心,以后都是内容的充实和边缘的扩充而已”。其中对“重心”的理解正确的是
A、宗法制 B、分封制 C、郡县制 D、行省制
24、(12分)A、B代表不同物质,都是H、N、O、Na中的任意三种元素组成的强电解质,A的水溶液呈碱性,B的水溶液呈酸性,请找出A、B可能的两种组合。要求;相同浓度时,A1溶液中水的电离程度小于A2溶液中水的电离程度;相同浓度时,B1溶液中水的电离程度小于B2溶液中水的电离程度。
(1)写出化学式A1 ,A2 ,B1 ,B2 ;
(2)相同温度下,当A1、B1的物质的量浓度相等时,两溶液中水电离出的氢离子的物质的量浓度之比为 ;
(3)写出0.1mol·L-1的A2溶液中离子浓度大小排序 ;
⑷ B1溶液中水的电离程度小于B2溶液中水的电离程度,原因是 ;
(5)常温下,若B1、B2两溶液的pH=5,则两溶液中水电离出的氢离子的物质的量浓度之比为 。
长海高中高二期末考试
23、(16分)向2L密闭容器中通入amol 气体 A和bmol气体B,在一定条件下发生反应;

已知:平均反应速率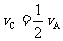 ;反应2min 时,A的浓度减少了
;反应2min 时,A的浓度减少了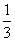 ,B的物质的量减少了
,B的物质的量减少了 mol,有a mol D生成。
mol,有a mol D生成。
回答下列问题:
(1)反应2min内,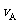 = ,
= ,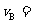 ;
;
(2)化学方程式中,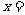 、
、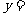 、
、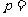 、
、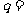 ;
;
(3)反应平衡时,D为2a mol,则B的转化率为
;如果只升高反应温度,其他反应条件不变,平衡时D为 1.5a mol,则该反应的 0;(填“>”、“<”或“=”)
0;(填“>”、“<”或“=”)
(4)如果其他条件不变,将容器的容积变为1L,进行同样的实验,则与上述反应比较:
①反应速率 (填“增大”、“减小”或“不变”),理由是 ;
②平衡时反应物的转化率 (填“增大”、“减小”或“不变”),理由是 ;
22、(12分)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,减少N的氧化物在大气中的排放是环境保护的重要内容之一。

Ⅰ Ⅱ
(1)图Ⅰ是1mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式 ;
又知:N2 (g) + O2 (g) = 2NO(g) △H= +180kJ·mol-1;
2NO(g) + O2(g) = 2NO2(g) △H= -112.3 kJ·mol-1;
则反应:2NO(g) + 2CO (g)  N2(g) + 2CO2 (g)的△H为
;
N2(g) + 2CO2 (g)的△H为
;
(2)一定温度下,在2L密闭容器中NO2和O2可发生下列反应:
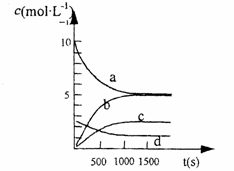
4NO2(g)+O2 (g)  2 N2O5(g);已知体系中n(NO2)随时间变化如下表:
2 N2O5(g);已知体系中n(NO2)随时间变化如下表:
|
t(s) |
0 |
500 |
1000 |
1500 |
|
n(NO2)(mol) |
20 |
13.96 |
10.08 |
10.08 |
①写出该反应的平衡常数表达式:K= ,已知:K300℃>K350℃,则该反应
是 热反应
②反应达到平衡后,NO2的转化率为 ,此时若再通入一定量氮气,则NO2
的转化率将 (填“增大”、“减小”、“不变”);
③图Ⅱ中表示N2O5 的浓度的变化曲线是 ,
用O2表示从0-500 s内该反应的平均速率v= 。
21、(10分)技术的发展与创新永无止境。我国化学家侯德榜改革国外的纯碱生产工艺,生产流程可简要表示如下图所示:
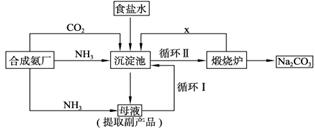
(1)向沉淀池中要通入CO2和氨气,应先通入_________(填化学式),原因是__________。
(2)沉淀池中发生反应的化学方程式是___ _______。
(3)母液中的溶质主要是__________,向母液中通氨气,加入细小食盐颗粒,冷却析出副产品,通氨气的作用是 。
20、 在一定温度下,反应1/2H2(g)+
1/2X2(g) HX(g)的平衡常数为4。若将1.0mol的HX(g)通入体积为1.0L的密闭容器中,在该温度时HX(g)的最大分解率接近于
在一定温度下,反应1/2H2(g)+
1/2X2(g) HX(g)的平衡常数为4。若将1.0mol的HX(g)通入体积为1.0L的密闭容器中,在该温度时HX(g)的最大分解率接近于
A. 17% B. 20% C. 25% D.33%
19、在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
|
物质 |
X |
Y |
Z |
|
初始浓度/mol·L-1 |
0.1 |
0.2 |
0 |
|
平衡浓度/mol·L-1 |
0.05 |
0.05 |
0.05 |
下列说法错误的是:
A.反应达到平衡时,X的转化率为50%
B.反应可表示为X+3Y 2Z,其平衡常数为8000
2Z,其平衡常数为8000
C.增大压强使平衡向生成Z的方向移动,平衡常数增大
D.改变温度可以改变此反应的平衡常数
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com