
25.A、B、C、D、E五种元素的原子序数依次增大,且均小于18;A原子的最外层比B原子的最外层少2个电子,A原子的最外层电子数是次外层电子数的两倍;A、B、C三种元素能结合成化合物C2AB3,在1 mol C2AB3中共有52 mol电子,D元素的单质0.5 mol与酸全部反应时,有9.03×1023个电子转移,在B与D形成的化合物中,D的质量分数为52.94%,D原子核内有14个中子,每个E原子与氢原子化合时只生成了一个共价单键。试填写下列空白。
(1)这五种元素的名称
A B C D E
(2) A与B形成的高价化合物属于 分子(填“极性”、“非极性”)。
(3) C在B中燃烧生成的化合物中化学键有 键和 键(填离子、极性、非极性)。
24.X、Y、Z、W是原子序数依次增大的短周期元素(稀有气体除外),其中两种为金属元素。X原子的原子半径是短周期元素中原子半径最大的,Y的单质可与浓NaOH溶液反应,X原子与Z原子最外层电子数之和为7。请回答下列问题:
(1) X和W形成的化合物的电子式为_______________
(2) Z的氢化物的相对分子质量与H2O2的相对分子质量相等,但其沸点却低于H2O2的沸点,理由______
(3) Y的单质与浓NaOH溶液反应的离子方程式是_________________________
(4) 0.1molW的单质与50mL1.5mol/L 的FeBr2溶液完全反应,则反应中被氧化的Fe2+和Br-的物质的量之比是_____________
23. A、B、C是三种常见的短周期元素,它们的原子序数逐渐增大,B元素原子最外层电子数是C元素原子最外层电子数的一半,A元素原子最外层电子数比B多一个。甲、乙、丙是三种最高价含氧酸的钠盐,甲中含B元素,乙中含C元素,丙中含A元素,甲、丙的水溶液均有较强的碱性,乙的水溶液pH小于7。丁为一种气体,戊为淡黄色固体。甲、乙、丙、丁、戊、已六种物质之间的相互反应关系如下图:(图中略去了物质转化时的部分生成物)

回答下列问题:
(1)写出A、B、C三种元素的元素符号 、 、 。
(2)写出戊的电子式 。
(3)若乙溶液不足量,乙溶液分别和甲、丙溶液也能发生化学反应,但生成物不是已和丁,写出不足量的乙溶液分别和甲溶液、丙溶液反应时的离子反应方程式:
乙+甲 ;乙+丙 。
(4)写出已溶液和丙溶液反应的离子方程式: 。
22.下表中的虚线部分为绘制元素周期表的雏形。①-⑥分别表示元素周期表中对应位置的元素。
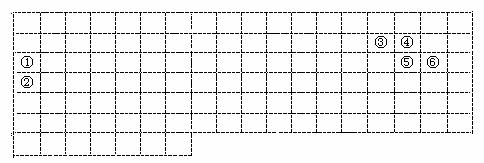
(1)请在上表中用实线补全短周期元素边界,并在对应部位标出主族符号。
(2)元素③氢化物的电子式为 ,其空间构型为 。
(3)元素④的氢化物沸点比元素⑤的氢化物沸点 (填“高”或“低”)。
(4)元素①②形成的合金通常情况下呈 态,可作为 。
21. 已知五种元素的原子序数的大小顺序为C>A>B>D>E,A、C同周期,B、C同主族。A与B形成离子化合物A2B,A2B中所有离子的电子数相同,其电子总数为30;D和E可形成4核10个电子分子。试回答下列问题:
(1).写出五种元素的元素符号:A_____、B_____、C______、D______、E______。
(2).用电子式表示离子化合物A2B的形成过程:________________ 。
(3).写出下列物质的电子式:
①D元素形成的单质__________ ; ②E与C形成的化合物__________;
③A、B、E形成的化合物__________; ④D与E形成的化合物_________ 。
20.下列叙述正确的是
A.电子层数少的元素原子半径一定小于电子层数多的元素的原子半径
B.核外电子层结构相同的单核微粒半径相同
C.质子数相同的不同单核微粒,电子数越多,半径越大
D.原子序数越大,原子半径越大
19.A、B、C、D四种短周期元素,其离子A+、B2+、C-、D2-具有相同的电子层结构,下列判断正确的是
A.原子序数由大到小的顺序是:B>A>C>D B.离子半径由大到小的顺序是:B2+>A+>C->D2-
C.A、B、C、D四种元素可能属于同一周期 D.A、B、C、D四种元素一定属于短周期元素
18.阴离子 含中子N个,X的质量数为A,则a gX的氢化物中含质子的物质的量是
含中子N个,X的质量数为A,则a gX的氢化物中含质子的物质的量是
A.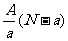 mol
B.
mol
B. mol
mol
C.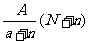 mol
D.
mol
D.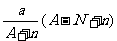 mol
mol
17.下列说法正确的是
A.难失去电子的原子,易形成阴离子
B.单质分子中不存在化学键,化合物的分子才存在化学键
C.离子化合物中一定含有离子键 D.离子化合物中一定含金属键
16.下列两核间距最小的离子化合物是
A.KCl B. NaF C. HF D. CaS
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com