
13.下列叙述正确的是
A.反应Na2O2 + 2HCl == 2NaCl + H2O2 为氧化还原反应
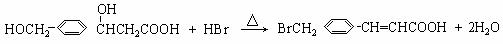
B.反应仅涉及消去反应类型
C.10mL 0.02mol/L AgNO3溶液与10mL 0.02mol/L HCl溶液混合后,溶液的pH=2(设溶液总体积不变)
D.10mL 0.04mol/L HCl溶液与10mL 0.02mol/L Na2CO3溶液混合后,溶液的pH=7(设溶液总体积不变)
12.常温下将稀NaOH溶液与稀CH3COOH溶液混合,不可能出现的结果是
A.pH > 7,且c(OH-) > c(Na+) > c(H+) > c(CH3COO-)
B.pH > 7,且c(Na+) + c(H+) = c(OH-) + c(CH3COO-)
C.pH < 7,且c(CH3COO-) >c(H+) > c(Na+) > c(OH-)
D.pH = 7,且c(CH3COO-) > c(Na+) > c(H+) = c(OH-)
11、关于小苏打水溶液的表述正确的是
A、c (Na+)=c (HCO3-) + c (CO32-) + c (H2CO3)
B、c (Na+) + c (H+) = c (HCO3-) + c (CO32-) +c (OH-)
C、HCO3- 的电离程度大于HCO3-的水解程度
D、存在的电离有:NaHCO3 = Na+ + HCO3-, HCO3-  H+ + CO32-
H2O
H+ + CO32-
H2O  H++OH-
H++OH-
10、经测定某溶液中只含NH4+、Cl-、H+、OH- 四种离子,下列说法错误的是( )
A.溶液中四种粒子之间不可能满足:c(Cl-)>c(H+)>c(NH4+)>c(OH-)
B.若溶液中粒子间满足:c(NH4+)>c(Cl-)>c(OH-)>c(H+),则溶液中溶质一定为:NH3·H2O和NH4Cl。
C.若溶液中粒子间满足:c(Cl-)>c(NH4+)>c(H+)>c(OH-),则溶液中溶质一定只有NH4Cl。
D.若溶液中c(NH4+)= c(Cl-),则该溶液一定显中性。
9、某酸的酸式盐NaHY在水溶液中,HY-的电离程度小于HY-的水解程度。下列有关叙述中正确的是( )
A. HY-的水解方程式为:HY-+ H2O H3O+ + Y2-
H3O+ + Y2-
B. H2Y的电离方程式为:H2Y+ H2O HY-+ H3O+
HY-+ H3O+
C.在该酸式盐溶液中,离子浓度的大小关系为:c(Na+)>c(HY-)>c(OH-)>c(H+)
D. 在该酸式盐溶液中,离子浓度的大小关系为:c(Na+)>c(Y2-)>c(HY-)>c(OH-)>c(H+)
8、下列离子组:①Al3+与OH-、②AlO2-与H+、③CO32-与H+、④Fe3+与S2-,不用其他任何试剂,只要相互滴加就能鉴别的是( )
A.①② B.①③ C.①②③ D.①②③④
7、下列离子组在溶液中可以大量共存的是( )
A. pH=0的溶液中Na+、CH3COO-、Cl-、Cu2+ B. pH=14的溶液中K+、AlO2-、CO32-、NO3-
C. 使pH试纸变红的溶液中:Fe2+ 、I-、NO3-、ClO- D.中性溶液中:Mg2+ 、Fe3+、SO42-、Cl-
6、下列离子方程或化学方程式正确的是( )
A.SO2气体缓慢地通入Na2O2粉末中2Na2O2+2SO2=Na2SO3+O2
B.向含有0.1molNaOH的溶液中通入3.36L(标况)CO2气体:2OH-+CO2== CO32-+H2O
C.Fe(NO3)2中加入盐酸:3Fe2++4H++NO3-=3Fe3++NO↑+2H2O
D.向100ml0.1mol/LFeBr2溶液中通入0.025molCl2:2Fe2++4Br-+3Cl2==2Fe3++2Br2+6 Cl-
5.已知某溶液中存在较多的H+、SO42-、NO3-,则该溶液中还可能大量存在的离子组是( )。
A.Al3+、CH3COO-、Cl- B.Mg2+、Ba2+、Br-
C.Mg2+、Cl- 、I-、 D.Na+、NH4+、Cl-
4.在PH=1含Ba2+离子的溶液中,还能大量存在的离子是( )。
A.AlO2- B.ClO- C.Cl- D.SO42-
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com