
13、 右图是温度和压强对X + Y
右图是温度和压强对X + Y  2Z 反应影响的示意图。图中横坐标表示温度,纵坐标表示平衡混合气体中Z的体积分数。
2Z 反应影响的示意图。图中横坐标表示温度,纵坐标表示平衡混合气体中Z的体积分数。
下列叙述正确的是
A.上述可逆反应的正反应为放热反应
B.X、Y、Z均为气态
C.X和Y中只有一种是气态,Z为气态
D.上述反应的逆反应的△H>0
|
KIO3 + 3H2↑。下列有关说法正确的是( )
A.电解时,石墨作阴极,不锈钢作阳极
B.电解时,阳极反应是:I –+ 3H2O → IO3 – + 6H++ 6e –
C.阳极发生了还原反应
D.电解前后溶液的pH明显减小
11、氢氧燃料电池以 H2 为还原剂, O2 为氧化剂,电极为多孔镍,电解液为 30% 的 KOH 溶液,下列有关叙述正确的是 ( ) ①负极反应为 4OH-→O 2 + 2H 2 O+ 4 e- ②负极反应为 H 2 + 2OH-→ 2H 2 O+ 2 e- ③工作时正极区 pH 升高,负极区 pH 降低 ④工作时溶液中阴离子移向正极 A. ③④ B. ②③ C. ②④ D.①④ 12、铜板上铁铆钉处的吸氧腐蚀原理如下图所示,下列有关说法正确的是( )。
 A.正极电极反应式为:2H++2e-→H2↑
A.正极电极反应式为:2H++2e-→H2↑
B.此过程中还涉及到反应:4Fe(OH)2+2H2O+O2=4Fe(OH)3
C.此过程中Fe、Cu均被腐蚀
D.此过程中电流从Fe移向Cu
10、下列各组离子能大量共存与同一溶液中,且加入过量NaOH溶液或少量稀硫酸时,都能产生白色沉淀的是
A、Ba2+、Mg2+、NO3-、CO32- B、Na+、Al3+、Cl-、Ba2+
C、K+、Ba2+、Cl-、HCO3- D、NH4+、Ba2+、Fe3+、Cl-
9、浓度均为0.1 mol/L的下列五种溶液①Na2CO3溶液 ②NaOH溶液 ③NaHSO4溶液
④NH4Cl溶液 ⑤NaNO3溶液,PH的大小顺序为
A. ②﹥①﹥⑤﹥④﹥③ B。②﹥①﹥⑤=③﹥④
C. ①﹥②﹥⑤﹥④﹥③ D. ②﹥①﹥⑤﹥③﹥④
8、25 ℃时,水的电离达到平衡:H2O H++OH-,下列叙述正确的是
H++OH-,下列叙述正确的是
A.向水中加入氨水,平衡逆向移动,c(OH-)降低
B.向水中加入少量固体硫酸氢钠,c(H+)增大,KW不变
C.向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低
D.将水加热,KW增大,pH不变
7、下列说法正确的是( )。
A.含有H+离子的溶液一定呈酸性
B.0.1 mol/L KOH溶液和0.1 mol/L氨水中,其c(OH-)相等
C.pH为1的盐酸的c(H+)是pH为3的盐酸的100倍
D.Na2 CO3溶液中,c(Na+)是c(CO32-)的两倍
6、在一定温度下,向a L密闭容器中加入1 mol X气体和2 mol Y气体,发生如下反应:X(g)+2Y(g)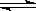 2Z(g),此反应达到平衡的标志是
2Z(g),此反应达到平衡的标志是
A. 容器内压强不随时间变化 B. 容器内密度不随时间变化
C. 容器内X、Y、Z的浓度之比为1︰2︰2
D. 单位时间消耗0.1 mol X同时生成0.2 mol Z
5、中和相同体积、相同pH的硫酸、盐酸和醋酸三种稀溶液,所用相同浓度的NaOH溶液的体积分别为V1、V2、V3,则三者的大小关系为( )
A.V3>V2>V1 B.V3=V2>V1
C.V3>V2=V1 D.V1=V2>V3
4、工业氧化二氧化硫制三氧化硫反应的化学方程式为:2SO2(g)+
O2 (g)  2SO3(g)
△H=-198kJ·mol-1假设这个反应处于平衡状态,在体积不变的条件下,下列措施会使化学平衡逆向移动的是
2SO3(g)
△H=-198kJ·mol-1假设这个反应处于平衡状态,在体积不变的条件下,下列措施会使化学平衡逆向移动的是
A.增加二氧化硫 B。升高温度 C。降低温度 D。移出三氧化硫
3、已知0.1 mol/L的醋酸溶液中存在电离平衡: CH3COOH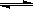 CH3COO-+H+ 要使溶液中c(H+)/c(CH3COOH)比值增大,可以采取的措施是( )。
CH3COO-+H+ 要使溶液中c(H+)/c(CH3COOH)比值增大,可以采取的措施是( )。
A.加少量CH3COONH4固体 B.降低温度 C.加少量NaOH固体 D.加水稀释
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com