
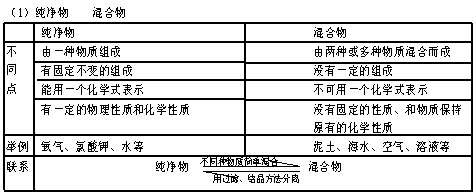
(一)物质的性质和变化
1、物质的性质
物理性质:物质不需要发生化学变化就能表现出来的性质
例如:颜色、状态、气味、熔点、沸点、密度、硬度、溶解性等
化学性质:物质在化学变化中表现出来的性质
例如:氧化性、还原性、酸性、碱性、可燃性、稳定性等
2、物质的变化
物理变化:没有新物质生成的变化
化学变化:有新物质生成的变化,又称化学反应。
①化学反应的分类
a.按反应前后的物质种类分
化合反应 A+B=C
|

 例:4P+502 2P205 CaO+H20 Ca(OH)
2
例:4P+502 2P205 CaO+H20 Ca(OH)
2
|
 例:2H2O
2H2↑+O2↑
例:2H2O
2H2↑+O2↑
置换反应 A+BC=AC+B
例:Fe+2HCI--FeCl2+H2 ↑
复分解反应 AB+CD=AD+CB
例:NaOH+HCl--NaCl+H20
b.从得氧、失氧的角度分
|
 例:3Fe+2O2
Fe3O4
例:3Fe+2O2
Fe3O4
还原反应 : 含氧化合物里的氧被夺去的反应

 例:CuO+H2 Cu+H20
例:CuO+H2 Cu+H20
CuO失氧变成Cu,发生还原反应。
H2能使CuO发生还原反应而具有还原性,是还原剂。
②溶液中的置换反应和复分解反应发生的条件
溶液中的置换反应包括金属跟酸溶液、金属跟盐溶液的反应。这两类置换反应能否发生,要根据金属的活动性顺序进行判断:只有排在氢前面的金属才能跟盐酸、稀硫酸反应生成氢气和另一种盐;只有排在前面的金属才能把排在后面的金属,从它的盐溶液中置换出来。
值得注意的是,金属活动顺序只适用于在水溶液里发生的反应,不适用于在高温或非溶液状态下发生的反应;有铁参加的置换反应只能生成亚铁盐。
复分解反应是指酸、碱、盐之间发生的反应。其实质是两种化合物在溶液中相互交换离子生成两种新化合物。复分解反应能否发生,要考虑是否有沉淀、气体或水生成。
③化学反应遵循的定律-质量守恒定律
a.内容:参加化学反应的各反应物质量的总和,等于反应后各生成物的质量总和。
|
c.应用:质量守恒定律是书写、配平化学方程式的依据;是进行有关化学方程式计算的基础。应用质量守恒定律时,要着重理解“参加化学反应”的涵义和搞清楚反应前后各物质的质量“总和”是指什么。
对于反应前的物质来讲,强调的是“参加化学反应”的物质质量。没有参加反应的物质的质量不能计入。对于反应后的物质来讲,强调“反应后生成的”物质质量,生成的气体、沉淀物等都要计入生成物的质量总和中去。
④能改变化学反应速率的物质--催化剂
在化学反应过程中能改变其它物质的化学反应速率,而本身的质量和化学性质在反应前后都没有改变的物质,叫做催化剂。
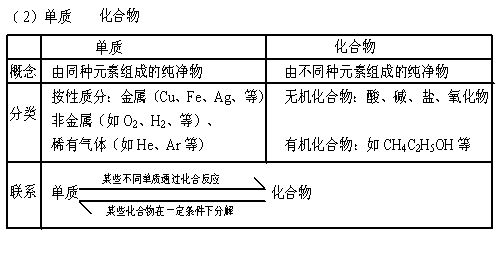
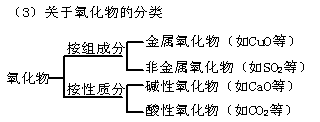
 基础知识 (理解单质、化合物的概念;其余是了解层次;要求能判断常见物质的类别)
基础知识 (理解单质、化合物的概念;其余是了解层次;要求能判断常见物质的类别)
|

化合价(化合价和化学式的关系 C )

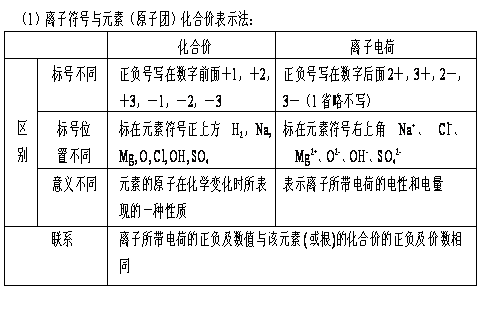

|
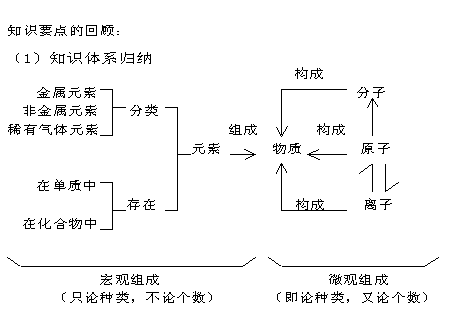
具 体 细 知 识 点:
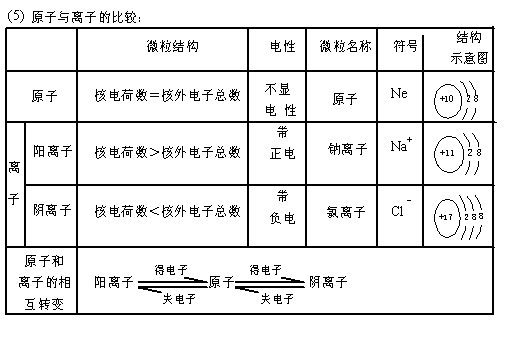
(2)构成物质的三种微粒-分子、原子、离子
|



|
22.2g×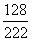 = [(22.2g -X)+
= [(22.2g -X)+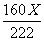 ]×67.0%
]×67.0%
X=11.1g
答:(略)。
22.2g×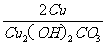 = [(22.2g -X)+
= [(22.2g -X)+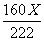 ]×67.0%
]×67.0%
2. 运用:
综合计算是把化学式、化学反应方程式、质量、质量分数、原子量、相对分子质量、溶液计算、等知识融为一体。这就要学会用不同的方法,从不同的角度,不同层次进行求解,从而在练习中掌握、提高并总结综合计算的基本技能。
例7:将氯化钠和碳酸钠的混合物33.8g放入125g稀盐酸中,恰好完全反应,得氯化钠溶液150g。计算:(1)原混合物中碳酸钠的质量;(2)若将所得溶液稀释成质量分数为8%的溶液,需要加水多少克?
分析:此题属于化学方程式综合计算。题目中混有的杂质溶于水,并且和生成物之一相同。并且要根据质量守恒定律分析找到可以带入化学方程式计算的纯质量。
答案为:解反应生成的二氧化碳质量为:33.8g+125g-150g=8.8g
设原混合物中碳酸钠质量为X,反应生成的氯化钠质量为Y;
稀释时加水的质量为Z
 Na2CO3 +
2HCl 2NaCl + H2O
+ CO2↑
Na2CO3 +
2HCl 2NaCl + H2O
+ CO2↑
106 117 44
X Y 8.8g
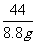 =
=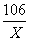
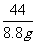 =
=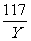
X=21.2g Y=23.4g
(1)Na2CO3质量为:21.2g
(2)反应后溶质NaCl的总质量:23.4g+(33.8g-21.2g)=36g
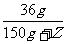 ×100%=8% Z=300g
×100%=8% Z=300g
答:(略)。
例8:取22.2g碱式碳酸铜固体,加热(温度在100℃以上)一段时间后,冷却至室温,测得固体剩余物中铜元素的质量分数为67.3%。计算:固体剩余物中未分解的碱式碳酸铜的质量。
分析:此题中给出的数据都不能直接使用,要注意题目中的隐含条件:反应前后铜元素质量不变,来列式,解方程。
答案为:解设已分解的碱式碳酸铜的质量为X
△
 Cu2(OH)2CO3
2CuO+H2O+CO2↑
Cu2(OH)2CO3
2CuO+H2O+CO2↑
222 160
X
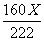
根据题意: 反应前后铜元素质量不变。
1. 要点
(1) 能把化学基本概念、基本原理定律等有关知识结合起来进行综合性较强的计算;
(2) 学会审清题意,审明条件,确准解题依据;
(3) 学会类比联想,遵循解题规律,灵活转化思路。
2. 运用:
(1) 善于应用化学反应中的守恒关系--质量守恒。
(2) 善于运用化学反应中各反应物和生成物之间的质量关系。
(3) 善于抓住反应前后元素种类和原子质量、原子数目不变。
例4:3g碳在10g氧气中燃烧,生成二氧化碳的质量是 ( )
A. 13g B. 11g C. 13.75g D. 5.5g
分析:任何化学反应都遵循质量守恒定律,此反应中碳、氧气、生成的二氧化碳的质量比为:3:8:11。题中碳的质量为3g,而对应给出的氧气质量大于8g,为10g,说明参加化学反应的氧气质量为8g,反应后剩余氧气2g,而生成的二氧化碳质量为11g。
答案为B。
例5:实验室用含碳酸钙80%的石灰石125g与足量的稀盐酸反应制取二氧化碳。可制得标况下二氧化碳多少升?(标况下ρ=1..977g/L)
分析:此题涉及不纯原料(或产品)的有关计算,并示范解题格式。
答案为:解:设二氧化碳质量为X
 CaCO3+2HCl CaCl2+H2O+CO2↑
CaCO3+2HCl CaCl2+H2O+CO2↑
100 44
125g×80% X
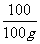 =
= X=44g
X=44g
二氧化碳的体积为: 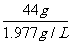 =22.2L
=22.2L
答:可制得标况下的二氧化碳22.2L。
例6:有未知溶质质量分数的氢氧化钠溶液50g,取出10g与27g质量分数为10%的氯化铜溶液恰好完全反应,所余氢氧化钠溶液恰好就、可以中和196g稀硫酸,求稀硫酸中溶质的质量分数?
分析:此题涉及多步反应的计算
答案为:解设氢氧化钠溶液中溶质质量分数为X%,稀硫酸中溶质的质量分数为Y%
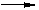 CuCl2 + 2NaOH Cu(OH)2↓ + 2NaCl
CuCl2 + 2NaOH Cu(OH)2↓ + 2NaCl
135 80
27g×10% 10g·X%
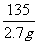 =
= X %= 16%
X %= 16%
 2NaOH +
H2SO4
Na2SO4
+ 2H2O
2NaOH +
H2SO4
Na2SO4
+ 2H2O
80 98
(50g-10g)×16% 196g·Y%
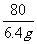 =
=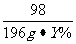 Y%=4%
Y%=4%
答:稀硫酸中溶质的质量分数为4%。
1. 要点
 反应物生成物之间的质量比
反应物生成物之间的质量比
化学方程式 纯或不纯原料(或产品)的有关计算
涉及多步反应的计算
涉及有关过量问题的计算
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com