
10.消毒、杀菌,是抗“非典”消毒剂。一种家用环保消毒液产生装置。其原理中用石墨作电极电解饱和氯化钠溶液,制得有较强杀菌能力的消毒液,该仪器的原理如图所示,
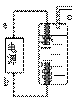 试回答:(1)“84”消毒液在日常生活中被广泛使用。该消毒液无色,
试回答:(1)“84”消毒液在日常生活中被广泛使用。该消毒液无色,
pH大于7,对某些有色物质有漂白作用。你认为它可能的有效成分
是 A.SO2 B.Na2CO3 C.KMnO4 D.NaClO
(2)写出电极名称 a极 ,b极 。
(3)消毒液的有效成分是 。
(4)写出有关离子方程式 。
(5)若在电解过程中因温度上升,生成了少量的NaClO3,即发生了反应:3Cl2 + 6 NaOH =5 NaCl + NaClO3 + 3H2O 测量得n (NaClO):n(NaClO3) = 5∶1,则整个过程中,氧化产物与还原产物的物质的量之比是 。
答案:(1)D(2)由"为使氯气完全被吸收"应在电解槽下部产生氯气,故a极为负极,b极为正极。(3)由方程式:Cl2 + 2 NaOH = NaCl + NaClO + H2O有效成分为:NaClO
(4)2Cl- + H2O=2 OH- + H2↑ + Cl2↑ Cl2 + 2OH-= Cl- + ClO- + H2O(5)由于整个过程氯气完全被吸收,氯化钠、水为原料,所以H2、 NaClO与NaClO3为产物;其中H2为还原产物,和为氧化产物,由:1mol Cl→1mol ClO-失电子2 mol,1mol Cl→1mol ClO3-失电子6 mol,若设NaClO为5 mol则NaClO3为1mol,氧化产物为6mol,共失电子:5 mol×2 + 6 mol = 16mol,而生成1mol H2需转移电子2mol,则:n(H2)= 16mol/2 = 8 mol,故氧化产物与还原产物的物质的量之比是: 6:8=3:4
8.用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,向所得的溶液中加入0.1mol CuO后恰好恢复到电解前的浓度和PH。则电解过程中转移的电子数为( D ) A、0.1mol B、0.2mol C、0.3mol D、0.4mol 9.已知蓄电池在充电时作电解池,放电时作原电池。铅蓄电池上有两个接线柱,一个接线柱旁标有“+”,另一个接线柱旁标有“-”。关于标有“+”的接线柱,下列说法中正确的是
A.充电时作阳极,放电时作正极
B.充电时作阳极,放电时作负极
C.充电时作阴极,放电时作负极
D.充电时作阴极,放电时作正极
7.关于电解NaCl水溶液,下列叙述正确的是 ( B )
A.电解时在阳极得到氯气,在阴极得到金属钠
B.若在阳极附近的溶液中滴入KI溶液,溶液呈棕色
C.若在阴极附近的溶液中滴入酚酞试液,溶液呈无色
D.电解一段时间后,将全部电解液转移到烧杯中,充分搅拌后溶液呈中性
6..氢镍电池是近年开发出来的可充电电池,它可以取代会产生污染的铜镍电池。氢镍电池的总反应式是 (1/2)H2+NiO(OH)= Ni(OH)2。根据此反应式判断,下列叙述中正确的是( CD )
A..电池放电时,电池负极周围溶液的OH-不断增大
B..电池放电时,镍元素被氧化
C..电池充电时。氢元素被还原
D..电池放电时,H2是负极
5.用惰性电极电解M(NO3)x的水溶液,当阴极上增重ag时,在阳极上同时产生bL氧气(标准状况):从而可知M的原子量为 ( C )
A.22.4ax/b B.11.2ax/b C.5.6ax/b D.2.5ax/b
4.下列关于铜电极的叙述正确的是 ( AC )
A.铜锌原电池中铜是正极 B.用电解法精炼铜时粗铜作阴极
C.在镀件上电镀铜时可用金属铜作阳极 D.电解稀硫酸制H2、O2时铜作阳极
3.钢铁发生吸氧腐蚀时,正极上发生的电极反应是 ( C )
A.2H++2e- =H2 B.Fe2++2e- =Fe
C.2H2O+O2+4e-=4OH- D.Fe3++e-=Fe2+
2.实验室用铅蓄电池作电源电解饱和食盐水制取氯气,已知铅蓄电池放电时发生如下反应:Pb+2H2SO4+PbO2 = 2PbSO4+2H2O今若制得Cl20.050摩,这时电池内消耗的H2SO4的物质的量至少是 ( C )
A.0.025摩 B.0.050摩 C.0.10摩 D.0.20摩
原电池:负极:M-n e-=Mn+
正极:(1)、酸性溶液中 2 H+ +2 e-=H2↑
(2)、不活泼金属盐溶液 Mn++n e- =M
(3)、中性、弱酸性条件下 2 H2O +O2+4 e-=4 OH-
电解(镀)池:
阳极:⑴若阳极是由活性材料(除C、Pt、Au等以外的其它金属)做成,阳极反应是阳极金属失去电子而被氧化成阳离子;
⑵若阳极是由C、Pt、Au等惰性材料做成,阳极反应则是电解液中阴离子在阳极失去电子被氧化。阴离子失去电子能力大小顺序为:I->Br-> Cl- > OH- >含氧酸根>F-。
阴极:阴极反应一般是溶液中的阳离子得电子的还原反应,阳离子得电子能力大小顺序为:
Ag+>Hg2+>Fe3+>Cu2+>H+>Pb2+>Fe2+>Zn2+>Al3+>Mg2+>Na+>Ca2+>K+。
必须注意的是,电镀时通过控制条件,Fe2+和Zn2+得电子的能力强于H+。
针对性练习
1.将分别盛有熔融的氯化钾、氯化镁、氧化铝的三个电解槽串联,在一定条件下通电一段时间后, 析出钾、镁、铝的物质的量之比为 ( D )
A.1:2:3 B.3:2:1 C.6:3:1 D.6:3:2
(二)确定电解(镀)池电极名称的方法
方法一:与外电源正极连接的一极是阳极、与负极连接的一极是阴极。
方法二:电极上发生氧化反应的是阳极,发生还原反应的是阴极。
方法三:阴离子移向的一极是阳极,阳离子移向的一极是阴极。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com