
【解析】:A阳极反应式应为:4OH--42e-=2H2O+O2↑,B钠的还原性比铁强,C前者转移电子数为4,后者为8.
【答案】D
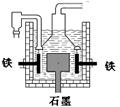 3Fe+4NaOH
3Fe+4NaOH Fe3O4+2H2↑十4Na↑。下列有关说法正确的是
Fe3O4+2H2↑十4Na↑。下列有关说法正确的是
A.电解熔融氢氧化钠制钠,阳极发生电极反应为:
2OH--2e-=H2↑+O2↑
B.盖?吕萨克法制钠原理是利用铁的还原性比钠强
C.若戴维法与盖?吕萨克法制得等量的钠,则两反应中转移的电子总数也相同
D.目前工业上常用电解熔融氯化钠法制钠(如图),电解槽中石墨极为阳极,铁为阴极
14.早在1807年化学家戴维用电解熔融氢氧化钠制得钠, 4NaOH(熔)  4Na + O2↑+ 2H2O;后来盖?吕萨克用铁与熔融氢氧化钠作用也制得钠,反应原理为:
4Na + O2↑+ 2H2O;后来盖?吕萨克用铁与熔融氢氧化钠作用也制得钠,反应原理为:
Ca(OH)2(s) Ca2++2OH-
加入以下溶液,可使Ca(OH)2减少的是
Ca2++2OH-
加入以下溶液,可使Ca(OH)2减少的是
A. Na2S溶液 B. AlCl3溶液 C. NaOH溶液 D. CaCl2溶液
【解析】: Na2S水解显碱性,增大了溶液中OH-的浓度;NaOH 提供大量OH-;CaCl2会增大Ca2+的浓度,所以A、C、D选项都会使溶解平衡向左移动,而AlCl3中的Al3+消耗OH-,使平衡向右移动,促进Ca(OH)2的溶解。
【答案】B
13.把氢氧化钙放入蒸馏水中,一定时间后达到如下平衡:
【解析】溶液稀释后,pH向7的方向过渡,若是强碱,稀释100倍后pH会从11→9,现是弱碱,所以pH为11~9之间,排除C、D二选项。在②中,〖思路一〗盐酸过量,n(OH-)很小,忽略不计,所以b = n(NH4+ )+n(H+) = 0.1 mol+0.1 mol = 0.2 mol,选B;〖思路二〗由电荷守恒n(NH4+ )+n(H+) = n(OH-)+n(Cl-),得:n(NH4+ )+n(H+)-n(OH-) = n(Cl-) = b = 0.2 mol,选B。
【答案】B
C.12~13之间;0.2 D.13;0.1
A.9~11之间;0.1 B.9~11之间;0.2
12.常温下,有甲、乙两份体积均为
11.铀(U)常见化合价有+4价和+6价,硝酸铀酰[UO2(NO3)2]加热可发生如下反应:UO2(NO3)2 UxOy+NO2↑+O2↑(化学方程式未配平),在600 K时将气体产物集满试管,并倒扣水中,水充满试管。则上述分解反应生成的铀的氧化物化学式为
UxOy+NO2↑+O2↑(化学方程式未配平),在600 K时将气体产物集满试管,并倒扣水中,水充满试管。则上述分解反应生成的铀的氧化物化学式为
A.UO2 B.UO?UO
【解析】化合价升降法:从气体全部被水吸收可知:硝酸铀酰的分解反应中,N元素的降价与O元素的升价已相等,从而推出:U元素没变价,即仍为+6价,故选C。
【答案】C
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com