
 20.将镁片、铝片平行插入到一定浓度的NaOH溶液中,用导线连接成闭合回路,该装置在工作时,下列叙述正确的是
20.将镁片、铝片平行插入到一定浓度的NaOH溶液中,用导线连接成闭合回路,该装置在工作时,下列叙述正确的是
A. 镁比铝活泼,镁失去电子被氧化成Mg2+
B. 铝是电池负极,开始工作时溶液中会立即有白色沉淀生成
C. 该装置的内、外电路中,均是电子的定向移动形成电流
D. 该装置开始工作时,铝片表面的氧化膜可不必处理
【解析】在NaOH溶液中,铝能与NaOH溶液发生氧化还原反应,在该反应中,铝失电子作原电池的负极,由于铝片表面的氧化膜也能与NaOH溶液反应,故其不必处理;由于电池开始工作时,生成的铝离子的量较少,相对的NaOH过量,此时不会有Al(OH)3白色沉淀生成;该装置外电路,是由电子的定向移动形成电流,而内电路,则是由溶液中自由移动的离子的定向移动形成电流。故答案为D。
【答案】D
19.下列有关溶液的叙述正确的是
A. 常温下的醋酸铵溶液呈中性,则溶液中c(H+)=c(
B. 在pH=2的醋酸溶液中加入等体积c(酸)=2mol?L-1的某酸溶液后,混合溶液的pH一定会减小
C. pH相同的醋酸溶液和盐酸,分别用蒸馏水稀释至原溶液的m倍和n倍,若稀释后两溶液的pH仍相同,则m>n
D. 导电性强的溶液中自由移动离子数目一定比导电性弱的溶液中自由移动离子数目多
【解析】常温下的醋酸铵溶液,铵根离子和醋酸根离子均会水解,它们分别水解得到的H+和OH-的浓度相等,故溶液呈中性,此时,由于水的离子积没变c(H+)=c(OH-)=10-7mol?L-1;B项中若加入的酸的酸性比醋酸还要弱,则有可能使溶液的pH增大;溶液的导电性取决于溶液中自由移动离子的浓度而非数目,D项错。
【答案】A C
 A.B点的横座标a==12.5,且有c(Na+)==c(CH3COO―)
A.B点的横座标a==12.5,且有c(Na+)==c(CH3COO―)
B.C点时,c(CH3COO―)>c(Na+)>c(H+)= c(OH―)
C.D点时,c(CH3COO―)+ c(CH3COOH)==
D.对曲线上A、B间任何一点,溶液中都有:
c(Na+)>c(CH3COO―)>c(OH―) >c(H+)
【解析】A不对,因二者刚好反应时,由于生成物水解,溶液呈碱性,故c(Na+)不等于c(CH3COO―);B不对,当c(H+)= c(OH―)时,根据电荷守恒c(Na+)==c(CH3COO―);C正确,根据物料守恒;D不对,初始阶段 c(OH―) > c(CH3COO―)
【答案】C
18.
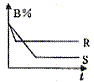 17.下图中的两条曲线分别表示
17.下图中的两条曲线分别表示 C(g),△H体系中B的百分含量和时间t的关系,下列对△H的数值和表示
C(g),△H体系中B的百分含量和时间t的关系,下列对△H的数值和表示
A. △H<0,R曲线 B. △H>0,R曲线
C. △H<0,S曲线 D. △H>0,S曲线
【解析】由图像中的曲线可知R曲线先达到平衡(先“拐”先“平”),所以R为
【答案】A。

下列判断一定错误的是
A.图I研究的是不同催化剂对反应的影响,且乙使用的催化剂效率较高
B.图Ⅱ研究的是压强对反应的影响,且甲的压强较高
C.图Ⅱ研究的是温度对反应的影响,且甲的温度较高
D.图Ⅲ研究的是不同催化剂对反应的影响,且甲使用的催化剂效率较高
【解析】图I中,说明条件的改变不仅影响化学反应速率,而且影响了化学平衡,而催化剂不影响化学平衡,因此A项是错误的。图Ⅱ在乙条件下的化学反应速率,比在甲条件下的化学反应速率慢,如果该条件是压强对反应的影响,从化学反应速率来讲,是甲的压强较高,减压平衡要向逆向移动,乙中B的转化率应降低,因此B项也是错误的。温度高化学反应速率快,则甲的温度高,升温平衡该反应逆向移动,甲中B的转化率低于乙中B的转化率,因此C项是正确的。催化剂只改变化学反应速率不影响化学平衡,因此D项是正确的。
【答案】A B
16.在容积固定的密闭容器中存在如下反应:A(g)+3B(g)
某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,并根据实验数据作出下列关系图:
 【答案】BC。
【答案】BC。
【解析】此类题目首先要根据题给信息,确定各元素在周期表中的相对位置,然后根据元素周期律加以对照。具体解答为:设C的原子序数为Z,则A的原子序数为Z+n,B的原子序数则为Z-n,则原子序数为A>C>B,A错。因An+、Bn-具有相同的电子层结构,阴离子半径大于阳离子半径,即 ,B项正确。An+、Bn-都应具有稀有气体的电子层结构,C的电子层结构相同于An+、Bn-,所以C必为稀有气体元素的原子;B、C为同一周期的元素,而A应处于B、C下一周期的左半部,故A的原子半径应大于B。D项错误。
,B项正确。An+、Bn-都应具有稀有气体的电子层结构,C的电子层结构相同于An+、Bn-,所以C必为稀有气体元素的原子;B、C为同一周期的元素,而A应处于B、C下一周期的左半部,故A的原子半径应大于B。D项错误。
15.具有相同电子层结构的三种微粒An+、Bn-、C,下列分析正确的是
A.原子序数关系:C>B>A
B.微粒半径关系:Bn->An+
C.C微粒是稀有气体元素的原子
D.原子半径关系是A<B<C
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com