
24、(12分)A、B代表不同物质,都是H、N、O、Na中的任意三种元素组成的强电解质,A的水溶液呈碱性,B的水溶液呈酸性,请找出A、B可能的两种组合。要求;相同浓度时,A1溶液中水的电离程度小于A2溶液中水的电离程度;相同浓度时,B1溶液中水的电离程度小于B2溶液中水的电离程度。
(1)写出化学式A1 ,A2 ,B1 ,B2 ;
(2)相同温度下,当A1、B1的物质的量浓度相等时,两溶液中水电离出的氢离子的物质的量浓度之比为 ;
(3)写出0.1mol·L-1的A2溶液中离子浓度大小排序 ;
⑷ B1溶液中水的电离程度小于B2溶液中水的电离程度,原因是 ;
(5)常温下,若B1、B2两溶液的pH=5,则两溶液中水电离出的氢离子的物质的量浓度之比为 。
长海高中高二期末考试
23、(16分)向2L密闭容器中通入amol 气体 A和bmol气体B,在一定条件下发生反应;

已知:平均反应速率 ;反应2min 时,A的浓度减少了
;反应2min 时,A的浓度减少了 ,B的物质的量减少了
,B的物质的量减少了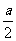 mol,有a mol D生成。
mol,有a mol D生成。
回答下列问题:
(1)反应2min内, = ,
= , ;
;
(2)化学方程式中,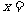 、
、 、
、 、
、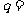 ;
;
(3)反应平衡时,D为2a mol,则B的转化率为
;如果只升高反应温度,其他反应条件不变,平衡时D为 1.5a mol,则该反应的 0;(填“>”、“<”或“=”)
0;(填“>”、“<”或“=”)
(4)如果其他条件不变,将容器的容积变为1L,进行同样的实验,则与上述反应比较:
①反应速率 (填“增大”、“减小”或“不变”),理由是 ;
②平衡时反应物的转化率 (填“增大”、“减小”或“不变”),理由是 ;
22、(12分)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,减少N的氧化物在大气中的排放是环境保护的重要内容之一。


Ⅰ Ⅱ
(1)图Ⅰ是1mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式 ;
又知:N2 (g) + O2 (g) = 2NO(g) △H= +180kJ·mol-1;
2NO(g) + O2(g) = 2NO2(g) △H= -112.3 kJ·mol-1;
则反应:2NO(g) + 2CO (g)  N2(g) + 2CO2 (g)的△H为
;
N2(g) + 2CO2 (g)的△H为
;
(2)一定温度下,在2L密闭容器中NO2和O2可发生下列反应:
4NO2(g)+O2 (g)  2 N2O5(g);已知体系中n(NO2)随时间变化如下表:
2 N2O5(g);已知体系中n(NO2)随时间变化如下表:
|
t(s) |
0 |
500 |
1000 |
1500 |
|
n(NO2)(mol) |
20 |
13.96 |
10.08 |
10.08 |
①写出该反应的平衡常数表达式:K= ,已知:K300℃>K350℃,则该反应
是 热反应
②反应达到平衡后,NO2的转化率为 ,此时若再通入一定量氮气,则NO2
的转化率将 (填“增大”、“减小”、“不变”);
③图Ⅱ中表示N2O5 的浓度的变化曲线是 ,
用O2表示从0-500 s内该反应的平均速率v= 。
21、(10分)技术的发展与创新永无止境。我国化学家侯德榜改革国外的纯碱生产工艺,生产流程可简要表示如下图所示:

(1)向沉淀池中要通入CO2和氨气,应先通入_________(填化学式),原因是__________。
(2)沉淀池中发生反应的化学方程式是___ _______。
(3)母液中的溶质主要是__________,向母液中通氨气,加入细小食盐颗粒,冷却析出副产品,通氨气的作用是 。
20、 在一定温度下,反应1/2H2(g)+
1/2X2(g) HX(g)的平衡常数为4。若将1.0mol的HX(g)通入体积为1.0L的密闭容器中,在该温度时HX(g)的最大分解率接近于
在一定温度下,反应1/2H2(g)+
1/2X2(g) HX(g)的平衡常数为4。若将1.0mol的HX(g)通入体积为1.0L的密闭容器中,在该温度时HX(g)的最大分解率接近于
A. 17% B. 20% C. 25% D.33%
19、在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
|
物质 |
X |
Y |
Z |
|
初始浓度/mol·L-1 |
0.1 |
0.2 |
0 |
|
平衡浓度/mol·L-1 |
0.05 |
0.05 |
0.05 |
下列说法错误的是:
A.反应达到平衡时,X的转化率为50%
B.反应可表示为X+3Y 2Z,其平衡常数为8000
2Z,其平衡常数为8000
C.增大压强使平衡向生成Z的方向移动,平衡常数增大
D.改变温度可以改变此反应的平衡常数
18、在25 mL 0.1 mol/L NaOH溶液中逐滴加入0.2 mol/L CH3COOH溶液,曲线如下图所示,有关粒子浓度关系正确的是

A.在A、B间任一点,溶液中一定都有c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
B.在B点,a>12.5,且有c(Na+)=c(CH3COO-)=c(OH-)=c(H+)
C.在C点:c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
D.在D点:c(CH3COO-)+c(CH3COOH)=2c(Na+)
17、下列关于电池的说法不正确的是
A.生铁在氯化钠溶液中易生锈是因为发生了吸氧腐蚀
B.氢气、氧气、硫酸溶液形成的燃料电池总反应为2H2 + O2 = 2H2O
C.甲醇、氧气,氢氧化钾溶液形成的燃料电池,随着反应进行,溶液PH不断减小
D.铅蓄电池放电时,溶液PH不断减小
16、 已知25℃时,CaSO4在水中沉淀溶解平衡曲线如图所示,向100 mL该条件下的CaSO4饱和溶液中,加入400 mL 0.01 mol/L的Na2SO4溶液,针对此过程的下列叙述正确的是
已知25℃时,CaSO4在水中沉淀溶解平衡曲线如图所示,向100 mL该条件下的CaSO4饱和溶液中,加入400 mL 0.01 mol/L的Na2SO4溶液,针对此过程的下列叙述正确的是
A.溶液中析出CaSO4固体沉淀,最终溶液中c(SO42-)较原来大
B.溶液中无沉淀析出,溶液中c(Ca2+)、
c(SO42-)都变小
C.溶液中析出CaSO4固体沉淀,溶液中c(Ca2+)、
c(SO42-)都变小
D.溶液中无沉淀析出,但最终溶液中c(SO42-)较原来大
14、已知:Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.5×10-16 ,Ksp(Ag2CrO4)=2.0×10-12,则下列难溶盐的饱和溶液中,Ag+浓度大小顺序正确的是
A.AgCl>AgI> Ag2CrO4 B.AgCl> Ag2CrO4>AgI
C.Ag2CrO4>AgCl>AgI D.Ag2CrO4>AgI>AgCl
|
 A.石墨电极上产生氢气
A.石墨电极上产生氢气
B.铜电极发生还原反应
C.铜电极接直流电源的负极
D.当有0.1mol电子转移时,有0.1molCu2O生成。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com