
1.“20世纪初,帝国主义的殖民体系形成但又过时。”导致这种“过时”的最主要原因是:
A.资本主义经济的发展 B.民族解放运动的兴起
C.列强力量对比的变化 D.局部战争的不断变化
25.
一定温度下,向如图所示带有可移动活塞的密闭容器中充入2 L SO2 和1 L
O2 的混合气体,发生如下反应2 SO2 (g) + O2
(g) 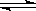 2
SO3 (g) 。
2
SO3 (g) 。
(1) 若活塞可自由移动,平衡后,活塞停止在“2.1”处,则该反应中SO2 的转化率为 。
 (2)
若开始时,充入容器的起始物质分别是
(2)
若开始时,充入容器的起始物质分别是
①2 L SO2 和1 L O2 ;
②2 L SO3 (g) 和 1 L N2 ;
③1 L SO2 、1 L O2 和 1 L SO3 (g),
使活塞固定在“3”处,达到平衡后,容器中SO3 (g)占反应混合物的体积分数的大小关系是:
(用序号和“<”、“=”、“>”表示)。
(3) 向(1)平衡后的容器中充入0.2 mol 的SO3,活塞移动后再次达到平衡时,测得此过程中从外界共吸收了1.96 kJ 的热量。
写出SO2 发生氧化反应的热化学方程式: 。
浙江嘉兴一中09-10学年高二下学期4月月考
24.现有反应:mA(g)+nB(g) pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
(1)该反应的逆反应为_________热反应,且m+n_______p(填“>”“=”“<”)。
(2)减压时,A的质量分数_________。(填“增大”“减小”或“不变”,下同)
(3)若加入B(保持体系体积不变),则A的转化率_________,B的转化率_________。
(4)若升高温度,则平衡时B、C的浓度之比 将______ ___。
将______ ___。
(5)若B是有色物质,A、C均无色,则加入C(体积不变)时混合物颜色_______,而维持容器内压强不变,充入氖气时,混合物颜色_______(填“变深”“变浅”或“不变”)。
23. 如下图所示的装置,C、D、E、F都是惰性电极。
将电源接通后,向乙中滴入酚酞试液.在F极附近显红色。试回答以下问题:
(1)电极A的名称是 。
(2)甲装置中电解反应的总化学方程式是 ______________________________ 。

(3)若用惰性电极电解饱和NaCl溶液一段时间,当阳极产生56L(标准状况下)气体,电解后溶液体积为500L时,产物的物质的量浓度为__________。
(4)欲用丙装置给铜镀银,G应该是 (填“银”或“铜”), 电镀液的主要成分是(填化学式) 。
22. ⑴北京奥运会祥云火炬将中国传
⑴北京奥运会祥云火炬将中国传
统文化、奥运精神以及现代高科技融为一体。
火炬内熊熊大火来源于丙烷的燃烧,丙烷是
一种优良的燃料。试回答下列问题:
① 右图是一定量丙烷完全燃烧生成
CO2和1mol H2O(l)过程中的能量变化图,请在附图中的括号内填入“+”或“-”。
②写出表示丙烷燃烧热的热化学方程式:
___________________________________。
③二甲醚(CH3OCH3)是一种新型燃料,应用前景广阔。1mol二甲醚完全燃烧生成CO2和液态水放出1455kJ热量。若1mol丙烷和二甲醚的混合气体完全燃烧生成CO2和液态水共放出1645kJ热量,则混合气体中,丙烷和二甲醚的物质的量之比为_______。
⑵盖斯定律认为:不管化学过程是一步完成或分数步完成,整个过程的总热效应相同。试运用盖斯定律回答下列问题:
已知: H2O(g)=H2O (l) △H1=-Q1 kJ/mol
C2H5OH(g)=C2H5OH (l) △H2=-Q2 kJ/mol
C2H5OH (g)+3O2(g)=2CO2(g)+3H2O(g) △H3=-Q3 kJ/mol
若使23g液态无水酒精完全燃烧,并恢复到室温,则整个过程中放出的热量为____________kJ。
21、某化学兴趣小组要完成中和热的测定。
(1)实验桌上备有烧杯(大、小两个烧杯)、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃棒、0.5mol· L-1 盐酸、0.55mol· L-1NaOH溶液,尚缺少的实验玻璃用品是 、 。
(2)实验中能否用环形铜丝搅拌棒代替环形玻璃搅拌棒?
(填“能”或“否”),其原因是 。
(3)他们记录的实验数据如下:
|
实 验 用 品 |
溶 液 温 度 |
中和热 △H |
|||
|
t1 |
t2 |
||||
|
① |
50mL0.55mol.L-1NaOH |
50mL.0.5mol.L-1HCl |
20℃ |
23.3℃ |
|
|
② |
50mL0.55mol.L-1NaOH |
50mL.0.5mol.L-1HCl |
20℃ |
23.5℃ |
已知:Q=Cm(t2 -t1),反应后溶液的比热容C为4.18KJ·℃-1· Kg-1,各物质的密度均为1g·cm-3。
根据实验结果写出NaOH溶液与HCl溶液反应的热化学方程式:
(4)若用KOH代替NaOH,对测定结果 (填“有”或“无”)影响。
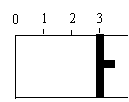
20. 有一电解池中X,Y分别是直流电源的两极,通电后发现a极板质量增加,b极板处有无色无臭气体放出,符合这一情况的是(
)
有一电解池中X,Y分别是直流电源的两极,通电后发现a极板质量增加,b极板处有无色无臭气体放出,符合这一情况的是(
)
|
组合 |
a极板 |
b极板 |
X电极 |
Z溶液 |
|
A |
锌 |
石墨 |
负极 |
CuSO4 |
|
B |
石墨 |
石墨 |
负极 |
NaOH |
|
C |
银 |
铁 |
正极 |
AgNO3 |
|
D |
铜 |
石墨 |
负极 |
CuCl2 |
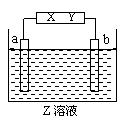
19. 如图所示,杠杆A、B两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,小心地向水槽中滴入CuSO4 浓溶液。(该过程中不考虑两球浮力的变化)下列说法正确的是( )
如图所示,杠杆A、B两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,小心地向水槽中滴入CuSO4 浓溶液。(该过程中不考虑两球浮力的变化)下列说法正确的是( )
A.若杠杆由绝缘体材料制成,一段时间后,杠杆一定B端高A端低
B.若杠杆由导体材料制成,一段时间后,杠杆一定B端高A端低
C.若杠杆由导体材料制成,一段时间后,杠杆一定A端高B端低
D.杠杆一定A端高B端低,与其材质无关
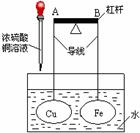
18.某研究组设想以如图所示装置用电化学原理生产硫酸。关于该装置的叙述正确的是
A.该装置为原电池,通入O2的电极是负极
B.该装置中,通入SO2的电极的电极反应式为:SO2-2e-+O2-+H2O=2H++SO42-
C.该装置中,H+通过质子膜向左侧移动
D.在标准状况下,理论上若通入SO2速率为2.24 L·min-1,则通入O2速率应为1.12 L·min-1

17.化学反应N2+3H2=2NH3的能量变化如图所示,该反应的热化学方程式是
A.N2(g)+3H2(g)=2NH3(l);
ΔH=2(a-b-c) kJ·mol-1
B.N2(g)+3H2(g)=2NH3(g);
ΔH=2(b-a) kJ·mol-1
C. N2(g)+
N2(g)+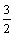 H2(g)=NH3(l);
H2(g)=NH3(l);
ΔH=(b+c-a) kJ·mol-1
D. N2(g)+
N2(g)+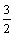 H2((g)=NH3(g);ΔH=(a+b) kJ·mol-1
H2((g)=NH3(g);ΔH=(a+b) kJ·mol-1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com