
1.(15分)A-J是中学化学中常见的几种物质,它们之间的转化关系如下图所示。已知E、F、G为气体单质,其他为化合物,A为淡黄色固体,B溶液是一种常见的强酸,I是难溶于水的白色胶状物质,E、F可化合生成D,J的阳离子和阴离子中均含金属元素。
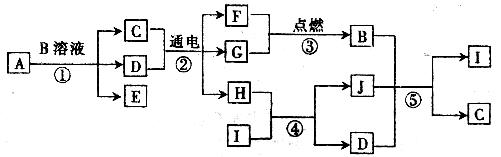
试回答下列问题;
(1)A的电子式为______________.
(2)写出下列物质的化学式:B__________,D_________,I__________.
(3)反应②若把原来的两个铂电极换成铜电极.则原产生G气体的电极发生的电极反应式为____________________________.
(4)B与J还可按4;1恰好完全反应,发生反应的化学方程式为 _______________________, 反应后的溶液在常温下的pH_______7(填“>”、“<”或“=”).
[答案](1)
(2)HCl H2O Al(OH)3
(3)Cu-2e-=Cu2+
(4)4HCl+NaAlO2=NaCl+AlCl3+2H2O <
[解析]本题考查元素及化合物转化关系。显然,A为Na2O2,E为氧气,A与强酸反应会生成水,因为E、F可化合生成D,所以F为氢气,D为H2O。C为盐溶液,电解该盐溶液得到氢气和另一种气体单质G应该为Cl2,B为HCl。C为NaCl,H为NaOH。能与NaOH反应的白色胶状物质为Al(OH)3,J为NaAlO2,NaAlO2与盐酸发生复分解反应生成Al(OH)3或者AlCl3。
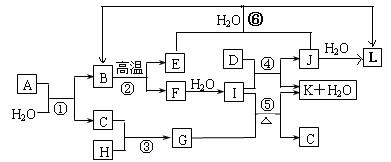
4. (原创)(15分)中学化学中几种常见物质的转化关系如图所示(图中部分反应物或生成物及反应条件未列出)。
已知:A、B、C、D、E是单质, X、Y、Z、M、N、W、H、K是化合物,其中B是短周期中半径最大的元素的单质、D和E为应用广泛的金属单质。请回答下列问题:
(1)组成C的元素的原子结构示意图是 ,E的空间构型______________。
(2)写出B在氧气中燃烧生成的产物与H2O反应的化学方程式 ;
(3)用惰性电极电解X的水溶液的阴极反应方程式 ;
(4)写出实验室制备M的化学方程式 ;
(5)写出用D、E做电极插入到Y的水溶液中形成原电池,则其负极反应方程式 ;
答案:(1) (1分); 三角锥型(2分)
(1分); 三角锥型(2分)
(2)2Na2O2+2H2O === 4NaOH + O2↑(3分)
(3)2H2O+2e-=H2↑+2OH-(3分)
(4)AlCl3+3NH3•H2O=Al(OH)3↓+3 NH4Cl
或2NaAlO2+CO2+3H2O= 2Al(OH)3↓+Na2CO3(3分)
(5)2Al-6e-+8OH-=2AlO2-+4H2O(3分)
[同步练习]
3. (原创)(10分)下图所示各物质是由1-20号元素中部分元素组成的单质或其化合物,图中部分反应条件和产物未列出。已知C、D、E、H是常见的气体且D为单质。反应②和④是化工生产中的重要反应,反应⑤是实验室制备气体C的重要方法,反应⑥是J的失效反应原理。
请回答下列问题:
⑴物质L的电子式为____________,E的结构式为_______________。
⑵D所含元素位于周期表__________________,生产D的工业被称为_______________。
⑶反应⑤的化学方程式为___________________________________________。
反应⑥的离子方程式为___________________________________________。
⑷物质A由三种元素组成,1molA与水反应可生成1molB和2molC,A的化学式为________。
答案:(⑴ 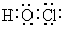 O=C=O(2分)
O=C=O(2分)
⑵第三周期VIIA族,氯碱工业(2分)
⑶Ca(OH)2+2NH4Cl CaCl2+2NH3↑+2H2O(2分)
CaCl2+2NH3↑+2H2O(2分)
Ca2++2ClO-+CO2+H2O=CaCO3↓+2HClO(2分)
⑷CaCN2(2分)
2. (原创)(15分)A-N为中学常见单质和化合物,转化关系如图所示。M、C、D为常见气体,G为黑色粉末,N为白色固体,A为水和一种干燥剂组成的混合物。部分反应产物已略去。反应①为工业生产中一个反应,反应②、③、④用于气体的实验室制备。回答下列问题:
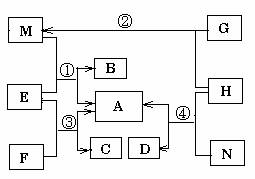
(1)M、C、D三种气体的溶解性从易到难为 (用化学式表示)。
(2)写出工业制备M的离子方程式_____________________________________________
(3)写出反应③的方程式___________________________________________________,
工业上制备C的生产条件是_______________________。
(4)在反应②和④中,H所起的作用有何不同________ ___。
答案:(1) NH3 >Cl2>CO2 (3分)
(2)2Cl-+2H2O H2↑+Cl2↑+2OH-(3分)
H2↑+Cl2↑+2OH-(3分)
(3)2NH4Cl+Ca(OH)2 2NH3+CaCl2+H2O(3分)
2NH3+CaCl2+H2O(3分)
500℃,20Mpa-50MPa,铁触媒(3分,少一个条件扣1分,不倒扣分)
(4)在反应②中,盐酸起酸性和还原性作用,在④中,盐酸起酸性作用(3分)
[解析]本题考查实验室制备与工业制备。A为水和一种干燥剂组成的混合物,显然A为CaCl2溶液。反应①③④均生成该混合物成为本题的连接点。结合常见的气体制备,制备CO2和NH3均生成CaCl2和H2O,此题找到突破口。G为黑色粉末,MnO2,MnO2与浓盐酸可以制备Cl2,Cl2与Ca(OH)2制备漂白粉也生成CaCl2和H2O混合物。NH3的工业制备用N2和H2合成,Cl2的工业制备为氯碱工业即电解饱和食盐水。
迅速浏览、整体扫描、产生印象、寻找突破口、注意联系、大胆假设、全面分析(正推或逆推),验证确认。解题的关键是仔细审题,依物质的特性或转移特征来确定“突破口”,顺藤摸瓜,进而完成全部未知物的推断。
原创展示
1、(原创)(15分)在下图转化关系中,固体甲的焰色反应呈黄色,M为常见的液体物质,酸G是重要的化工产品和化工原料;固体H能溶解在A和酸G且H为良好的耐火材料(图中部分产物没有列出)。

(1)写出M和过量的固体甲反应的化学方程式:
(2)
如图表示的是生产酸G的工业流程:
①乙设备的名称为
②气体X的主要成分为
③写出设备甲A中常见的化学反应
(3)固体乙与M反应的化学方程式为 ;
答案:(1)Na2O2+SO2=Na2SO4(3分)
(2)①接触室(2分) ②SO2、O2、N2(3分)
③4FeS2 + 11O2  2Fe2O3 + 8SO2(3分,其他合理也给分)
2Fe2O3 + 8SO2(3分,其他合理也给分)
(3)Al2S3+6H2O 2Al(OH)3↓+3H2S↑(4分)
2Al(OH)3↓+3H2S↑(4分)
[解析]本题是无机推断题,主要考查硫酸的工业流程。明显的突破口是液体M与气体F合成酸,马上就可以确定液体M为水;固体甲的焰色反应呈黄色,且能与水得到气体,马上确定固体甲为Na2O2,A为NaOH、气体B为O2;固体H能溶解在NaOH和酸G且H为良好的耐火材料,马上联想到H为两性氧化物Al2O3,D为Al(OH)3;结合生产酸G的工业流程,可以确定是硫酸的工业合成,酸G:硫酸、气体C:H2S、气体E:SO2、气体F:SO3。固体乙与水反应得到Al2S3+H2O Al(OH)3↓+H2S↑。设备甲为沸腾炉发生4FeS2 + 11O2
Al(OH)3↓+H2S↑。设备甲为沸腾炉发生4FeS2 + 11O2
 2Fe2O3
+ 8SO2;设备乙接触室将SO2转化成SO3,由于是一个可逆反应,则气体X的主要成分为SO2、O2、N2。
2Fe2O3
+ 8SO2;设备乙接触室将SO2转化成SO3,由于是一个可逆反应,则气体X的主要成分为SO2、O2、N2。
无机推断题包括两种题型:一种为文字推断题,另一种为无机框图推断。
“无机文字推断题”属高考必考题型,其考查的知识面广、综合性强,涉及到元素化合物、物质结构,甚至包括化学计算、化学实验等知识的综合考查、命题的方式灵活、形式多样化。
“无机框图推断题”作为一种高考的常见题型,以元素化合物知识为主,集基本概念、基本理论为一体的综合性题目。具有考查知识面广、题型多变、思考容量大等特点。这既能考查学生掌握元素与化合物的知识量及掌握熟练程度,又能考查学生的逻辑思维能力,这类试题特点是综合性强、物质间关系复杂,导致学生解题时常常难以入手。
分析近几年高考试题,无机推断题的地位正在逐渐上升。从推理能力考查的特点分析,高考无机推断题中主要表现了以下几个特点:
(1)单信息、多信息并重。同一道推断题中,有的结论只要分析单个信息就可以得出,有的结论需要同时综合多条信息才能得出。
(2)正向、逆向、统摄三种形式的推理并重。有些结论的得出过程中,需要正向、逆向、统摄等三种推理形式。
(3)定性、定量分析并重。推断过程中既需要定性分析、又需要定量分析。
(4)计算和逻辑推理(讨论)并重。
22. 在下面语段的横线上填入恰当的内容,使句子前后呼应,意思完整。(6分)
班门弄斧,虽然不免会见笑于大方之家,但真正的方家大师是不会嘲笑你的,他们
对你的青涩会发出善意的微笑。因为班门里的长者知道: . ;
芳林秀美,是因为新叶催陈叶; , 。到班门前弄斧,向一流人
物挑战,你将 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com