
4、小红坐在第 5 排 24 号用(5,24)表示,则(6,27)表示小红坐在第__排__号。
3、P(-2,3)到  轴的距离是_____。
轴的距离是_____。
2、P(2,3)关于原点对称的点是_____。
1、点A(3,-2)关于 x 轴对称的点是_____。
38.[化学--选修有机化学基础](15分)A~J有如下转化关系(其中部分产物已略去)。已知E分子中含有一个连有4个不同原子或原子团的碳原子;C分子核磁共振氢谱中共有4个吸收峰,其峰面积比为4:3:2:1;1mol F与足量的新制Cu(OH)2在加热条件下充分反应可生成2mol红色沉淀。分析并回答问题: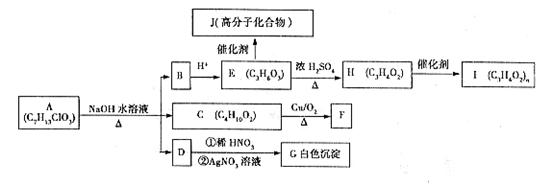
(1)A中含氧官能团的名称为________________________。
(2)C的结构简式为________________________。
(3)I的名称为________________________。
(4)H→I的反应类型为________________________。
(5)写出E→H反应的化学方程式________________________。
写出E→J反应的化学方程式________________________。
37.[化学--选修物质结构与性质](15分)下表为元素周期表的一部分。请回答下列问题:
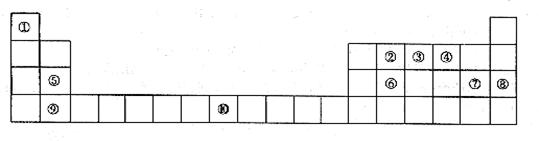
(1)上述元素中,属于s区的是________________________(填元素符号)。
(2)写出元素⑩的基态原子的电子排布式__________________________________________。
(3)元素第一电离能为⑤________________________⑨(填“大于”或“小于”)。
 (4)元素③气态氢化物的中心原子有________________________对弧对电子,其VSEPR模型为________________________;中心原子的杂化类型为________________________;该分子为________________________分子(填“极性”或“非极性”)。向硫酸铜溶液中逐滴加入其水溶液,可观察到的现象为________________________。
(4)元素③气态氢化物的中心原子有________________________对弧对电子,其VSEPR模型为________________________;中心原子的杂化类型为________________________;该分子为________________________分子(填“极性”或“非极性”)。向硫酸铜溶液中逐滴加入其水溶液,可观察到的现象为________________________。
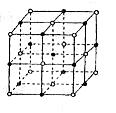
(5)元素⑦的钠盐晶胞结构如图所示,每个Na+周围与之距离最近的Na+的个数为________________________。若设该晶胞的棱长为a cm,阿伏加德罗常数的值为NA,则该钠盐的密度为________________________。
36.[化学--选修化学与技术](15分)
磷化铝、磷化锌、磷化钙是我国目前最常见的熏蒸杀虫剂,都能与水或酸反应产生有毒气体膦(PH3),PH3具有较强的还原性,能在空气中自然。我国粮食卫生标准(GB2175-2005)规定,粮食中磷化物(以PH3计)含量≤0.05mg/kg。
通过下列方法对粮食中残留磷化物含量进行测定。
[实验课题]粮食中残留磷化物的定量测定
[实验原理]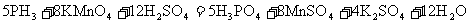
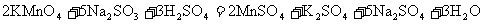
[操作流程]安装蒸馏吸收装置→PH3的产生与吸收→转移褪色→亚硫酸标准溶液滴定
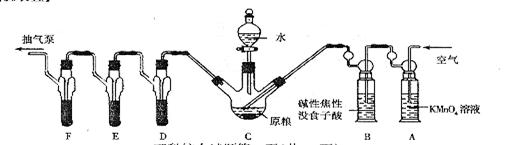 [实验装置]
[实验装置]
C中盛有200g原粮;D、E、F各盛装1.00mL浓度为1.00×10-3mol/L的KMnO4的溶液(H2SO4酸化)
(1)以磷化铝为例,写出磷化物与水反应的化学方程式________________________。
(2)检查上述装置气密性的方法是________________________。
(3)实验过程中,用抽气泵抽气的目的是________________________。
(4)A中盛装KmnO4溶液是为除去空气中可能含有的________________________;B中盛装碱性焦性没食子酸溶液的作用是________________________;如去除B装置,则实验中测得的PH3含量将________________________。
(5)收集D、E、F所得吸收液,并洗涤D、E、F,将吸收液、洗涤液一并置于锥形瓶中,加水稀释至25mL,用浓度为5×10-4mol/L Na2SO3标准溶液滴定剩余的KMnO4溶液,消耗Na2SO3标准溶液11.00mL,则该原粮中磷化物(以PH3计)的含量为_______________mg/kg。
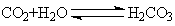
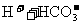
28.(14分)pC类似pH,是指极稀溶液中溶质物质的量浓度的常用对数负值。如某溶液溶质的浓度为1×10-3mol/L,则溶液中该溶质的pC = -lg10-3 = 3。已知H2CO3溶液中存在下列平衡:
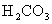
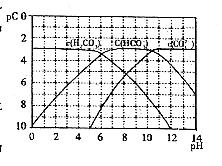


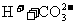
右图为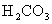 、
、 、
、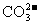 在加入强酸或强碱溶液后,平衡时溶液中三种成分的pC-pH图。请回答下列问题:
在加入强酸或强碱溶液后,平衡时溶液中三种成分的pC-pH图。请回答下列问题:
(1)在pH
= 9时,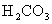 溶液中浓度最大的含碳元素离子为_______________。
溶液中浓度最大的含碳元素离子为_______________。
(2)pH<4时,溶液中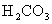 的pC值总是约等于3的原因是_______________。
的pC值总是约等于3的原因是_______________。
(3)一定浓度的NaHCO3和NaCO3混合溶液是一种“缓冲溶液”,在这种溶液中加入少量的强酸或强碱,溶液的pH变化都不大,请用离子方程式表示加入少量强碱后其pH变化不大的原因______________________________。
(4)已知M2CO3为难溶物,则其KSP的表达式为_______________;现欲将某溶液中的M+以碳酸盐(KSP = 1×10-12)的形式沉淀完全,则最后溶液中的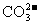 的pC最大值为_______________(溶液中的离子浓度小于1×10-5mol/L时,沉定完全)。
的pC最大值为_______________(溶液中的离子浓度小于1×10-5mol/L时,沉定完全)。
(5)若某溶液中含3mol Na2CO3,滴入一定量的稀盐酸,恰好使溶液中Cl-和 的物质的量之比为2:1,则滴入的盐酸中HCl的物质的量等于_______________mol。
的物质的量之比为2:1,则滴入的盐酸中HCl的物质的量等于_______________mol。
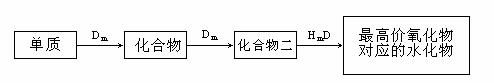
27.(14分)A、B、C、D、E是位于短周期的主族元素,其中A、B为金属元素。已知:①热稳定性:HmD>HmC;②Cm-、E(m-1)-具有相同的电子层结构;③B与E在同一周期,在该周期中,E的原子半径最小,B的离子半径最小;④A、B所形成的单核离子具有相同的电子层结构,B的最高价氧化物对应的水化物与A、E的最高价氧化物对应的水化物都能反应。依据上述信息用相应的化学用语回答下列问题:
(1)HmD的电子式:___________________。
(2)Cm-、E(m-1)-的还原性强弱为___________>___________,能证明其还原性强弱的离子方程式为_________________________________________________________。
(3)写出B的最高价氧化物对应的水化物和A的最高价氧化物对应的水化物反应的离子方程式_________________________________________________________。
(4)常温下,将等物质的量浓度的HmC溶液和A的最高价氧化物对应的水化物溶液等体积混合,所得溶液显碱性,溶液中离子浓度由大到小的顺序为___________________。
(5)在B、C、E单质中,符合下列转化关系的是___________________。
26.(15分)汽车尾气的主要成分为CO2及CO、NOX(NO和NO2)的混合物,其中NO的体积分数占95%以上)等。治理方法之一是在汽车排气管上加装“催化转换器”,利用催化剂使CO和NOX发生反应大部分转化为CO2和N2。某小组在实验室利用下图所示装置模拟汽车尾气处理中CO和NOX的反应并测量反应后混合气体的组成。(已知 )
)
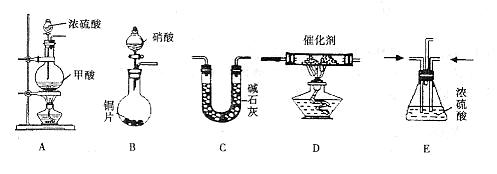
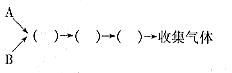
试回答下列问题:
(1)仪器的连接顺序为
(2)E装置的作用是___________________、___________________。
(3)写出D中的NOX与CO反应的化学方程式______________________________________。
(4)若B容器中生成的NOX为NO,写出该反应的化学方程式,并标出电子转移的方向和数目_________________________________________________________。
(5)若通入的NOX为NO,C装置增重8.8g,收集到的气体在标准状况下为4.48L(其相对分子质量为28.4)。则收集到的气体中NO的物质的量为___________________。
(6)选择高效催化剂,将汽车尾气转化为无毒气体,便彻底解决了汽车尾气对环境的影响,这种说法是否正确并阐述理由:_______________________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com