
23、(2分)一定量的盐酸和过量的锌粒反应产生氢气,为了减慢反应速率,又不影响产生的氢气的总量,下列措施可行的是 ①加入NaOH固体②加入一定量的水③加入少量硫酸钠溶液④加入少量硫酸铜溶液⑤加入CH3COONa固体⑥加入KNO3溶液。
22、(4分)由金红石(TiO2)制取单质Ti,涉及到的步骤为:
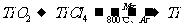
已知:①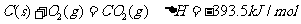
②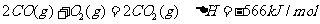
③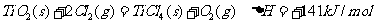
则(1) 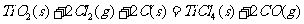 的
的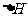 =________________。
=________________。
(2) 碳在氧气中不完全燃烧生成CO的热化学方程式为__________________________。
21、(4分)某同学设计用AlCl3溶液和Na2S溶液反应制取硫化铝(Al2S3)固体,你认为他能达到目的吗? 原因是(用离子方程式表示): 。配制Na2S溶液时,为了防止水解,常向溶液中加入少量 ,用离子方程式表示Na2S的水解 。
20、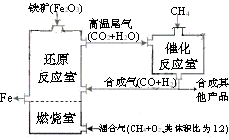 竖炉冶铁工艺流程如图,使天然气产生部分氧化,并在特殊的燃烧器中使氧气和天然气燃烧CH4(g)+2O2(g)=CO2(g)+2H2O(g),催化反应室发生的反应为:CH4(g)+H2O(g)
竖炉冶铁工艺流程如图,使天然气产生部分氧化,并在特殊的燃烧器中使氧气和天然气燃烧CH4(g)+2O2(g)=CO2(g)+2H2O(g),催化反应室发生的反应为:CH4(g)+H2O(g) 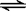 CO(g)+3H2(g)
∆H1=+216kJ/mol;CH4(g)+ CO2(g)
CO(g)+3H2(g)
∆H1=+216kJ/mol;CH4(g)+ CO2(g) 2CO(g) +
2H2(g) ∆H2=+260kJ/mol(不考虑其他平衡的存在),下列说法正确的是
2CO(g) +
2H2(g) ∆H2=+260kJ/mol(不考虑其他平衡的存在),下列说法正确的是
A.增大催化反应室的压强,甲烷的转化率减小
B.催化室需维持在550-750℃,目的仅是提高CH4转化的速率
C.设置燃烧室的主要目的是产生CO2和水蒸气作原料气与甲烷反应
D.若催化反应室中,达到平衡时,容器中n(CH4)=amol/L,n(CO)=bmol/L
n(H2)=cmol/L,则通入催化反应室的CH4的物质的量为a+(b+c)/4
第Ⅱ卷(40分)
19、某学生设计了一个“黑笔写红字”的趣味实验。滤纸先用
氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,
接通电源后,用铅笔在滤纸上写字,会出现红色字迹。据此,下列叙述正确的是:
A.铅笔端作阳极,发生还原反应 B.铂片端作阴极,发生氧化反应
C.铅笔端有少量的氯气产生 D.a点是负极,b点是正极
18、下列各溶液中,微粒的物质的量浓度关系正确的是( )
A.10mL0.5mol/LCH3COONa溶液与6mL1mol/L盐酸混合:
[Cl-]=[Na+]>[H+]>[OH-]
B.0.1mol/L pH=4的NaHB 溶液中:[HB-]>[H2B]>[B2-]
C.在NaHA溶液中一定有[Na+]+[H+]=[HA-]+[OH-]+[A2-]
D.[NH4+]相等的(NH4)2SO4溶液、(NH4)2CO3溶液和NH4Cl溶液:
 [(NH4)2SO4]<[(NH4)2CO3]<[NH4Cl]
[(NH4)2SO4]<[(NH4)2CO3]<[NH4Cl]
17、下列叙述正确的是( )
A.将稀氨水逐滴加入稀硫酸中,当溶液的pH=7时,c(SO42-)>c(NH4+)
B.两种醋酸溶液的物质的量浓度分别为c1和c2,pH的别为a和a+1,则c1=10c2
C.pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色
D.向0.1mol·L-1的氨水中加入少量硫酸铵固体,则溶液中c(OH-)/c(NH3·H2O)增大
16、下列反应的离子方程式错误的是( )
A.等体积等物质的量浓度的氢氧化钡溶液与碳酸氢铵溶液混合
Ba2+ + 2 OH- + NH4+ + HCO3- = BaCO3↓ + NH3·H2O + H2O
B.澄清石灰水与少量小苏打溶液混合 Ca2++OH-+HCO3- = CaCO3↓+H2O
C. 硫酸铝溶液和小苏打溶液反应 Al3++3 HCO3- = 3 CO2↑+Al(OH)3↓
D.氯化铝溶液中加入过量的氨水 Al3++4NH3·H2O = [Al(OH)4]-+4NH4+
15、蓄电池是一种可反复充电、放电的装置。它放电时起原电池的作用,将化学能转变为电能;而充电时电解池的作用,将电能转变为化学能贮存起来。某蓄电池充电和放电时发生的反应为:Fe + NiO2 + 2H2O Fe(OH)2 + Ni(OH)2
Fe(OH)2 + Ni(OH)2
关于此蓄电池有下列说法:
① 放电时,NiO 为正极;②充电时,阳极反应式为:Fe(OH)
为正极;②充电时,阳极反应式为:Fe(OH) +2e-→ Fe+2OH
+2e-→ Fe+2OH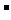 ;
;
③放电时,电解质溶液中的阳离子向正极方向移动;
④充电时,Ni(OH) 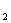 的反应式为:Ni(OH)
的反应式为:Ni(OH) 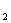 →NiO
→NiO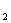 +2H
+2H +2e-;
+2e-;
⑤蓄电池的电极必须浸在碱性电解质溶液中;错误的是
A。 ③ B。② C。①③⑤ D。 ②和④
13、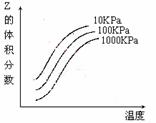 右图是温度和压强对X + Y
右图是温度和压强对X + Y  2Z 反应影响的示意图。图中横坐标表示温度,纵坐标表示平衡混合气体中Z的体积分数。
2Z 反应影响的示意图。图中横坐标表示温度,纵坐标表示平衡混合气体中Z的体积分数。
下列叙述正确的是
A.上述可逆反应的正反应为放热反应
B.X、Y、Z均为气态
C.X和Y中只有一种是气态,Z为气态
D.上述反应的逆反应的△H>0
|
KIO3 + 3H2↑。下列有关说法正确的是( )
A.电解时,石墨作阴极,不锈钢作阳极
B.电解时,阳极反应是:I –+ 3H2O → IO3 – + 6H++ 6e –
C.阳极发生了还原反应
D.电解前后溶液的pH明显减小
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com