
26、已知某金属晶体是面心立方堆积,金属原子的半径为a pm,摩尔质量为Mg/mol,阿伏加德罗常数为NA
求(1)该晶胞中含有原子的个数?(2分)
(2)该金属的密度(用a、M、NA来表示)(2分)
25、五种短周期元素A、B、C、D、E,原子序数依次增大,其中A、B同周期,且A、B原子核外均有两个未成对电子;A、D同主族,B、E同主族,且C的最外层电子比E的最外层电子少5个。根据以上信息,完成下列各题。
(1)写出下列化学用语:A: B: C: D: E: (5分)
(2)A的最高价氧化物的熔点 D的最高价氧化物的熔点(填“>”或“<”),原因是 ;B氢化物的沸点 E氢化物的沸点(填“>”或“<”),原因是 。(4分)
(3)选取上述五种元素,完成下列问题
①构成的原子晶体有 ;(3分)
②含有非极性键的离子化合物 (用电子式表示)(2分)
③含有极性键的非极性分子 (用电子式表示)(2分)
24、现有X、Y、Z、W四种短周期元素。
①X元素的单质在Y元素的单质中燃烧发出苍白色火焰,并生成气体A。
②Z元素的单质与A的水溶液反应又生成X元素的单质。
③Z元素的原子和Y元素的原子电子层数相同,且它们的最外层电子数之差的绝对值为奇数。
④W元素的原子核外有3个电子层,其最外层电子数等于电子层数。
请回答下列问题:
(1)X的元素符号为:_________;Z的元素名称是: 。(2分)
(2)A的电子式是 。(2分)
(3)Z的单质与A的溶液反应的离子方程式 。(2分)
(4)W的氧化物溶于NaOH中的化学方程式 。(2分)
23.第三主族的元素由于最外能层的p能级中有空轨道,故称为缺电子元素。
 (1)已知气态氯化铝的化学式为Al2Cl6,写出Al2Cl6的结构式____________________;
(1)已知气态氯化铝的化学式为Al2Cl6,写出Al2Cl6的结构式____________________;
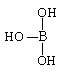
(2)硼酸的结构式可表示为 ,但硼酸溶于水后,1个硼酸分子与水作用,只能
产生1个H+,请写出硼酸溶于水后溶液显酸性的离子方程式:
(共4分)
22、不同元素的气态原子失去最外层一个电子所需要的能量(设其为E)如右图所示。试根据元素在周期表中的位置,分析图中吗线的变化特点,并回答下列问题。
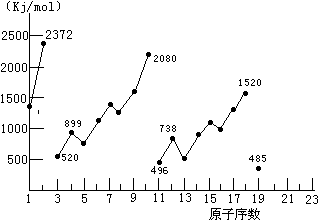
(1)同主族内不同元素的E值变化的特点是:__________________________(2分),各主族中E值的这种变化特点体现了元素性质的__________变化规律(1分)。
(2)同周期内,随原子序数增大,E值增大。但个别元素的E值出现反常现试预测下列关系式中正确的是______(填写编号,多选倒扣)(2分)
①E(砷)>E(硒) ②E(砷)<E(硒)
③E(溴)>E(硒) ④E(溴)<E(硒)
(3)估计1mol气态Ca原子失去最外层一个电子所需能量E值的范围:_____________<E<__________(2分)
(4)10号元素E值较大的原因是___________________(2分)
21、右表是元素周期表的一部分。(共7分)
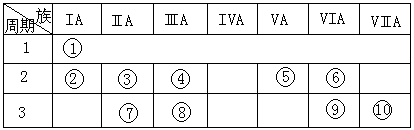
(1)表中元素⑩的氢化物的化学式为 ,此氢化物的还原性比元素⑨的氢化物的还原性 (填强或弱)
(2)某元素原子的核外p电子数比s电子数少1,则该元素的元素符号是 ,其单质的电子式为 。
(3)已知某些不同族元素的性质也有一定的相似性,如元素③与元素⑧的氢氧化物有相似的性质。写出元素③的氢氧化物与NaOH溶液反应的化学方程式
(2分)
又如表中与元素⑦的性质相似的不同族元素是 (填元素符号)
20、一种离子晶体的晶胞如右图。其中阳离子A以 表示,阴离子B以
表示,阴离子B以 表示。
表示。
(1)每个晶胞种含A离子的数目为________,含B离子数目为________。
 (2)若A的核外电子排布与Ar相同,B的电子排布与Ne相同,则该离子化合物的化学式是___________________;
(2)若A的核外电子排布与Ar相同,B的电子排布与Ne相同,则该离子化合物的化学式是___________________;
(3)阳离子的配位数为_________,阴离子的配位数为________。
(4)已知A的离子半径为0.99×10-10m,则该晶胞的体积是_______________m3。
(每空2分,共12分)
19、(每空1分,共12分)
H2O 分子构型 ,中心原子采取 杂化 ,属于 分子(填极性或非极性)
SO3 分子构型 ,中心原子采取 杂化,属于 分子(填极性或非极性)
HCN分子构型 ,中心原子采取 杂化,属于 分子(填极性或非极性)
CH4 构型 ,中心原子采取 杂化,属于 分子(填极性或非极性)
18.美国 lawrece liremore 国家实验室(LINL)的V·Lota·C·S·You和H·Cynn成功地在高压下将CO2转化为具有类似SiO2结构的晶体,下列关于CO2的原子晶体的说法正确的是( )
A.CO2的原子晶体和分子晶体互为同分异构体
B.在一定的条件下,转化为分子晶体是物理变化
C.CO2的原子晶体和分子晶体具有相同的物理性质和化学性质
D.在CO2的原子晶体中,每一个C原子周围结合4个O原子,每一个O原子跟两个碳原子结合
17、几种短周期元素的原子半径及主要化合价如下表:
|
元素代号 |
L |
M |
Q |
R |
T |
|
原子半径/nm |
0.160
|
0.143 |
0.102 |
0.089 |
0.074 |
|
主要化合价 |
+2 |
+3 |
+6、-2 |
+2 |
-2 |
下列叙述正确的是
A、R的氧化物对应的水化物可能具有两性
B、L、M的单质与稀硫酸反应速率:M>L
C、T、Q的氢化物常态下均为无色气体
D、L、Q形成的简单离子核外电子数相等t
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com