
16.在恒压密闭容器M(如图Ⅰ)和恒容密闭容器N(如图Ⅱ)中,分别加入a molA和a molB,起始时两容器体积均为V L,发生如下反应并达到化学平衡状态:2A(?)+ B(?) xC(g) ΔH<0,平衡时M中A、B、C的物质的量之比为1∶3∶4。下列判断不正确的是:
xC(g) ΔH<0,平衡时M中A、B、C的物质的量之比为1∶3∶4。下列判断不正确的是:

A.x =2
B.若N中气体的密度如图Ⅲ所示,则A、B只有一种是气态
C.若A为气体,B为非气体,则平衡时M、N中C的物质的量相等
D.若A、B均为气体,平衡时M中A的转化率小于N中A的转化率
15.通以相等的电量,分别电解等浓度的硝酸银和硝酸亚汞(亚汞的化合价为+1)溶液,若被还原的硝酸银和硝酸亚汞的物质的量之比n(硝酸银)︰n(硝酸亚汞)=2︰1,则下列表述正确的是:
A.在两个阴极上得到的银和汞的物质的量之比n(银)︰n(汞)=2︰1
B.在两个阳极上得到的产物的物质的量不相等
C.硝酸亚汞的化学式为HgNO3
D.硝酸亚汞的化学式为Hg2(NO3)2
14.爱迪生电池在充电和放电时发生的反应:Fe+ NiO2+2H2O Fe(OH)2+Ni(OH)2,
下列该蓄电池推断错误的是:
① 放电时,Fe参与负极反应,NiO2参与正极反应
② 充电时,阴极上的电极反应式为:Fe(OH)2 + 2e-= Fe + 2OH-
③ 放电时,电解质溶液中的阴离子向正极方向移动
④ 放电时,负极上的电极反应式为:Fe + 2H2O-2e- = Fe(OH)2 + 2H+
⑤ 蓄电池的电极必须浸入某种碱性电解质溶液中
A.只有③ B.③④ C.④⑤ D.①②⑤
13. 下列说法或表示方法中正确的是:
下列说法或表示方法中正确的是:
A.等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多。
B.已知C(s)+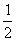 O2(g)=CO(g)的反应热为110.5kJ/mol,说明碳的燃烧热为110.5kJ。
O2(g)=CO(g)的反应热为110.5kJ/mol,说明碳的燃烧热为110.5kJ。
C.某温度下,体积一定的密闭容器中进行如下可逆反应:X(g)+Y(g) Z(g)+W(s)
ΔH>0。若平衡后加入X,则上述反应的ΔH增大。
Z(g)+W(s)
ΔH>0。若平衡后加入X,则上述反应的ΔH增大。
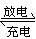 D.稀溶液中:H+(aq)+OH-(aq)=H2O(l) ΔH= -53.7kJ·mol-1 ,若将含0.5 molH2SO4的浓溶液与含1 molNaOH的溶液混合,放出的热量大于53.7KJ。
D.稀溶液中:H+(aq)+OH-(aq)=H2O(l) ΔH= -53.7kJ·mol-1 ,若将含0.5 molH2SO4的浓溶液与含1 molNaOH的溶液混合,放出的热量大于53.7KJ。
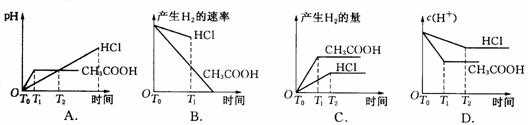
12.在体积都为0.1 L,pH都等于2的盐酸和醋酸溶液中,各投入0.65 g锌粒,则下图所示比较符合客观事实的是:
11.在火烧圆明园时流失了大量的国宝,如:铜铸的鼠首和兔首。普通铜器时间稍久容易出现铜绿,其主要成分是(Cu2(OH)2CO3),这两件1760年铜铸的国宝在240多年后看上去仍然熠熠生辉不生锈,下列对其原因的分析最可能的是: A.它们的表面都电镀上了一层耐腐蚀的黄金 B.环境污染日趋严重,它们表面的铜绿被酸雨溶解洗去 C.铜的金属活动性比氢小,因此不易被氧化 D.它是含一定比例金、银、锡、锌的铜合金
10.在中和热测定的实验中不需要用到的仪器是:
A.量筒 B.温度计 C.环形玻璃搅拌棒 D.天平
9.将pH试纸用蒸馏水湿润后,去测定某溶液的pH值,测得该溶液的pH值结果将会:
A.偏高 B.偏低 C.不变 D.上述三种情况均有可能
8.下列说法不正确的是:
A.能够发生化学反应的碰撞是有效碰撞
B.升高温度会加快化学反应速率,其原因是增加了活化分子的百分数
C.化学平衡发生移动,平衡常数必发生变化
D.测定HCl和NaOH反应的中和热时,每次实验均应测量3个温度,即盐酸的起始温度、
NaOH溶液的起始温度和反应后反应体系的最高温度
7.灰锡(以粉末状存在)和白锡是锡的两种同素异形体。
已知:①Sn(s、白)+2HCl(aq)=SnCl2(aq)+H2(g);DH1
②Sn(s、灰)+2HCl(aq)=SnCl2(aq)+H2(g);DH2
③Sn(s、灰)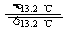 Sn(s、白);DH3=+2.1 kJ/mol
Sn(s、白);DH3=+2.1 kJ/mol
下列说法正确的是:
A.DH1>DH2 B.锡在常温下以灰锡状态存在
C.灰锡转化为白锡的反应是放热反应
D.锡制器皿长期处于低于13.2 ℃的环境中,会自行毁坏
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com