
26. 某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
①将碱式滴定管用蒸馏水洗净后,用待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2-3次;从碱式滴定管中放入20.00mL待测溶液到锥形瓶中。
②将酸式滴定管用蒸馏水洗净后,立即向其中注入0.1000mol/L标准硫酸,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数。
③向锥形瓶中滴入甲基橙作指示剂,进行滴定。滴定至指示剂刚好变色,且半分钟内颜色不再改变为止,测得所耗硫酸的体积为V1mL。
④重复以上过程,但在滴定过程中向锥形瓶加入5mL蒸馏水,测得所耗硫酸为V2mL。
试回答下列问题:
(1)锥形瓶中的溶液从 色变为 色时,停止滴定。
(2)滴定时边滴边摇动锥形瓶,眼睛应观察 (填序号)
A、滴定管内液面的变化 B、锥形瓶内溶液颜色的变化
 (3)上述操作步骤中两处错误分别是 ,
(请指出具体错误)。由此造成的测定结果分别是
, (填偏高、偏低或无影响)。
(3)上述操作步骤中两处错误分别是 ,
(请指出具体错误)。由此造成的测定结果分别是
, (填偏高、偏低或无影响)。
(4)某次滴定时的滴定管中的液面如图,则其读数为 mL。若记录读数时,起始时俯视,终点时仰视,则所测溶液浓度会 (填偏高、偏低或无影响)。
(5)根据下列数据:
|
滴定次数 |
待测液体积(mL) |
标准硫酸体积(mL) |
|
|
滴定前读数(mL) |
滴定后读数(mL) |
||
|
第一次 |
20.00 |
0.50 |
25.45 |
|
第二次 |
20.00 |
4.00 |
29.05 |
请计算待测烧碱溶液的浓度为 mol/L。
25.25℃时,在体积为2L的密闭容器中,气态物质A、B、C的物质的量n(mol)随时间t的变化如下图所示。已知达平衡后,降低温度,A的转化率将增大。
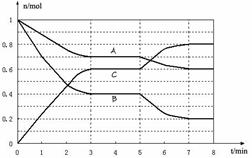
(1)根据上图数据,写出该反应的化学方程式____________________;此反应的平衡常数表达式K= 。从反应开始到达第一次平衡时的平均速率v(A)为 。
(2) 在5~7min内,若K值不变,则此处曲线变化的原因是 。
(3)下图表示此反应的反应速率v和时间t的关系图
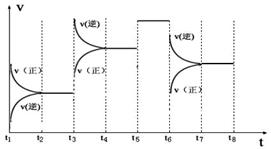
各阶段的平衡常数如下表所示:
|
t2 ~ t3 |
t4 ~ t5 |
t5 ~ t6 |
t7 ~ t8 |
|
K1 |
K2 |
K3 |
K4 |
根据上图判断,在t3和t6时刻改变的外界条件分别是_____________和______________;K1、K2、K3、K4之间的关系为: (用“>”、“<”或“=”连接)。A的转化率最大的一段时间是 。
24.现有甲、乙两种溶液:
甲 pH=2的醋酸溶液
乙 pH=2的盐酸
请根据下列操作回答问题:
(1)取10mL的甲溶液,加入等体积的水,醋酸的电离平衡 移动(填“向左”、“向右”或“不”);另取10mL的甲溶液,加入少量无水醋酸钠固体(假设加入固体前后,溶液体积保持不变),待固体溶解后,溶液中c(H+)/c(CH3COOH)的比值将 (填“增大”、“减小”或“无法确定”)。
(2)相同条件下,取等体积的甲、乙两溶液,各稀释100倍。稀释后的溶液,其pH大小关系为:pH(甲) pH(乙)(填“大于”、“小于”或“等于”)。
(3)各取25mL的甲、乙两溶液,分别用等浓度的NaOH稀溶液中和,则消耗的NaOH溶液的体积大小关系为:V(甲) V(乙)(填“大于”、“小于”或“等于”)。
(4)取25mL的甲溶液,加入等体积pH=12的NaOH溶液,反应后溶液中c(Na+)、c(CH3COO-)的大小关系为:c(Na+) c(CH3COO-)(填“大于”、“小于”或“等于”)。
23.同素异形体相互转化的反应热相当少而且转化速率较慢,有时还很不完全,测定反应热很困难,现在可根据盖斯定律进行计算。
已知:P4(s,白磷)+5O2(g)= P4O10(s) △H=-2983.2kJ·mol-1 ①
P(s,红磷)+O2(g)=P4O10(s) △H=-738.5kJ·mol-1 ②
(1)由热化学方程式来看,更稳定的磷的同素异形体是_______________________________。
(2)试写出白磷转化为红磷的热化学方程式___________________________________。
22.下列有关工业生产的叙述正确的是:
A.合成氨生产过程中将NH3液化分离,可加快正反应速率,提高N2、H2的转化率
B.硫酸工业中,在接触室安装热交换器是为了利用SO3转化为H2SO4时放出的热量
C.电解饱和食盐水制烧碱采用离子交换膜法,可防止阴极室产生的Cl2进入阳极室
D.电解精炼铜时,同一时间内阳极溶解铜的质量比阴极析出铜的质量小
21.如右图所示,A、F为石墨电极,B、E为铁片电极。则下列有关推断错误的是:
A.当打开K2,闭合K1时,装置①为原电池
B.当打开K1,闭合K2时,装置②为电解池
C.在U形管②中滴入酚酞试液,当打开K1,闭合K2时,E极周围溶液显红色
D.在U形管①中滴入酚酞试液,当打开K2,闭合K1时,B极周围溶液显红色
20.下列过程中△H小于零的是:
A.石灰石高温分解 B.氢氧化钡晶体与氯化铵反应
C.二氧化碳与碳反应 D.铝与盐酸的反应
19.反应N2O4(g)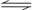 2NO2(g);△H= +57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是:
2NO2(g);△H= +57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是:
A.A、C两点的反应速率:A>C
B.A、C两点气体的颜色:A深,C浅
C.由状态B到状态A,可以用加热的方法
D.A、C两点气体的平均相对分子质量:A>C
18.用已知浓度的盐酸滴定未知浓度的NaOH溶液,选用酚酞作指示剂,下列操作会导致测定结果偏低的是:
A.酸式滴定管未润洗就装标准液滴定 B.锥形瓶未用待测液润洗
C.读取标准液读数时,滴前仰视,滴定到终点后俯视
 D.滴定前酸式滴定管尖嘴处有气泡未排除,滴定后气泡消失
D.滴定前酸式滴定管尖嘴处有气泡未排除,滴定后气泡消失
17.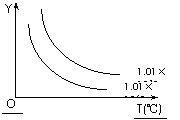
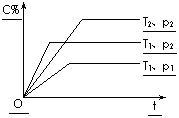 在体积一定的密闭容器中给定物质A、B、C,在一定条件下发生反应建立化学平衡:aA(g) + bB(g)
在体积一定的密闭容器中给定物质A、B、C,在一定条件下发生反应建立化学平衡:aA(g) + bB(g) xC(g),符合下图所示的关系(c%表示平衡混合气中产物C的百分含量,T表示温度,p表示压强)。在图中,Y轴是指 :
xC(g),符合下图所示的关系(c%表示平衡混合气中产物C的百分含量,T表示温度,p表示压强)。在图中,Y轴是指 :
A.平衡混合气体中物质A的百分含量 B.平衡混合气体中物质B的百分含量
C.平衡混合气体的密度 D.平衡混合气体的平均摩尔质量
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com