
5.向氨水中加入NH4Cl晶体,溶液的碱性 ( )
A.增强 B.减弱 C.不变 D.为零
4.20℃时H2S饱溶液1L,其浓度为0.1mol·L-1,其电离方程式为H2S===H++HS-,HS-===H++S2-,若要使该溶液[H+]及[S2-]都减小,可采取的措施是 ( )
A.加入适量的水 B.加入适量的NaOH固体
C.通入适量的SO2 D.加入适量的CuSO4固体
3.下列叙述中,能证明某物质是弱电解质的是 ( )
A.熔化时不导电 B.不是离子化合物,而是极性共价化合物
C.水溶液的导电能力很差 D.溶液中已电离的离子和未电离的分子共存
2.下列电离方程式中,错误的是 ( )
 A.Al2(SO4)3===2Al3++3SO42- B.HF H++F-
A.Al2(SO4)3===2Al3++3SO42- B.HF H++F-

 C.HI H++I-
D.Ca(OH)2 Ca2++2OH-
C.HI H++I-
D.Ca(OH)2 Ca2++2OH-
1.下列叙述中正确的是 ( )
A.物质的溶解过程,实质上就是其电离过程
B.二氧化硫的水溶液能导电,所以二氧化硫是电解质
C.1 L 0.1 mol·L-1的H2SO4溶液中含有0.2 mol的H+
D.1 L 0.2 mol·L-1的H2SO3溶液中含有0.2 mol的H+
27.(12分)在水溶液中橙红色的Cr2O72-与黄色的CrO42-有下列平衡关系.
Cr2O72-+H2O  2CrO42-+2H+,把K2Cr2O7溶于水配成稀溶液是橙色。
2CrO42-+2H+,把K2Cr2O7溶于水配成稀溶液是橙色。
(1)向上述溶液中加入NaOH溶液,溶液呈___________色,因为__________。
(2)向已加入NaOH溶液的(1)中再加入过量稀H2SO4,则溶液呈___________色,
因为__________。
(3)向原溶液中加入Ba(NO3)2溶液(已知BaCrO4为黄色沉淀)则平衡___________,
26.(8分)在一定温度下,把2 mol SO2和1 mol O2通入一个一定容积的密闭容器里,发
生如下反应.2SO2+O2 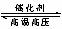 2SO3,当此反应进行到一定程度时,反应混合物
2SO3,当此反应进行到一定程度时,反应混合物
就处于化学平衡状态。现在该容器中,维持温度不变,令a、b、c分别代表初始加入
的SO2、O2和SO3的物质的量(mol)。如果a、b、c取不同的数值,它们必须满足一
定的相互关系,才能保证达到平衡时,反应混合物中三种气体的百分含量仍跟上述平
衡时完全相同。请填写下列空白.
(1)若a=0,b=0,则c= 。
(2)若a=0.5,b= 和c= 。
(3)a、b、c取值必须满足的一般条件是(请用两个方程式表示,其中一个只含a和c,
另一个只含b和c)_________________
25.(6分)在某固定容积的密闭容器中,存在下列化学平衡.
aA(g)
 bB(g)+cC(g),在温度不变的条件下,向容器中再充入
bB(g)+cC(g),在温度不变的条件下,向容器中再充入
一定量的A物质,重新达到平衡时,判断在下列情况下有关物质量的变化趋势
(在下列空白中填写“增大”“减小”或“不变”)
(1)当a=b+c时,B的物质的量分数___________。
(2)当a>b+c时,A的物质的量分数___________。
(3)当a<b+c时,A的转化率___________。
24.(9分)化学平衡移动原理,同样也适用于其他平衡,已知在氨水中存在下列平衡.
NH3+H2O  NH3·H2O
NH3·H2O  NH4++OH-
NH4++OH-
(1)向氨水中加入MgCl2固体时,平衡向__________移动,OH-的浓度__________,
NH4+的浓度_____。
(2)向氨水中加入浓盐酸,平衡向___________移动,此时溶液中浓度减小的粒子有
___________、___________、___________。
(3)向浓氨水中加入少量NaOH固体,平衡向______移动,此时发生的现象 __________。
23.(9分)将等物质的量的A、B、C、D四种物质混和,发生如下反应: aA+bB cC(固)+dD
cC(固)+dD
当反应进行一定时间后,测得A减少了n摩,B减少了 n摩,C增加了
n摩,C增加了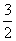 n摩,D
n摩,D
增加了n摩,此时达到化学平衡:
(1)该化学方程式中各物质的系数为 :a =______、b=________、c=______、d=______。
(2)若只改变压强,反应速度发生变化,但平衡不发生移动,该反应中各物质的聚集状态:
A___________、B__________、C____________、D________________
(3)若只升高温度,反应一段时间后,测知四种物质其物质的量又达到相等,则该反应为
__________________反应(填“放热”或“吸热”)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com