
2.共价化合物中只有共价键,离子化合物中一定含有离子键。如H2O(共价化合物)

 H O O H (由共价键形成),NaOH(离子化合物),Na+[
O H]-(由共价键和离子键形成)。
H O O H (由共价键形成),NaOH(离子化合物),Na+[
O H]-(由共价键和离子键形成)。
1.共价键可存在于单质分子、共价化合物分子和离子化合物中。
 分子
分子

 N2:电子式_________
结构式________ Cl2:电子式_________ 结构式________
N2:电子式_________
结构式________ Cl2:电子式_________ 结构式________
H2O:电子式_________ 结构式________
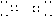 CO2: O C O (O=C=O)
CH4:电子式_________ 结构式_________
CO2: O C O (O=C=O)
CH4:电子式_________ 结构式_________
|
项 目 |
概 念 |
对分子的影响 |
|
键 能 |
拆开1摩共价键所吸收的能量或生成1摩共价键所放出的能量 |
键能大、键牢固、分子稳定 |
|
键 长 |
成键的两个原子的核间的平均距离 |
键越短、键能越大,键越牢固,分子越稳定 |
|
键 角 |
分子中相邻键之间的夹角 |
决定分子空间构型和分子的极性 |
定义:____________________________________________________ 叫共价键。
说明:①成键元素:通常为__________元素的原子间。②成键原因:同种或不同种元素的原子之间结合成分子时并不发生电子的完全得失,而是通过 __________ 而结合的。③共价键可以形成单质也可形成_________。
__________的原子之间形成的共价键称非极性共价键,简称非极性键;__________的原子之间形成的共价键称极性共价键,简称极性共价键。
2.化合物
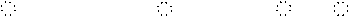 K2S:_________、 CaO:_________、 CaF2: _________
K2S:_________、 CaO:_________、 CaF2: _________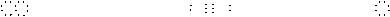 Na2O2: _________、、 CaC2:_________ 、 NaOH:_________
Na2O2: _________、、 CaC2:_________ 、 NaOH:_________
NH4Cl:_________
1.离子(按要求写电子式)
单核阳离子符号,即为阳离子的电子式,如H+、K+、Na+、Mg2+;
原子团的阳离子:如_________
单核阴离子:H - _________、 O 2-_________、Cl -_
原子团的阴离子: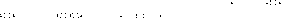 O H-_________、 C22-_________、 O 22-_________。
O H-_________、 C22-_________、 O 22-_________。
定义:____________________________________________________ 叫做离子键。
说明:①成键元素:活泼______(如:K、Na、Ca、Ba等,主要是ⅠA和ⅡA族元素)和活泼______(如:F、Cl、Br、O等,主要是ⅥA族和ⅦA族元素)相互结合时形成离子键。②成键原因:活泼______原子容易失去电子而形成阳离子,活泼______原子容易得到电子形成阴离子。当活泼金属遇到活泼非金属时,电子发生转移,分别形成阳、阴离子,再通过静电作用形成离子键。③离子键构成离子化合物。
定义:_______________________________________________________叫做化学键。
说明:直接相邻的原子间强烈的相互作用,破坏这种作用需较大能量。中学阶段所学的化学键主要为下列两种类型:
 离子键
离子键
化学键 ______共价键
共价键
______共价键
22.(本题满分16分)
已知函数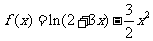 。
。
(I)求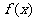 在
在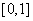 上的极值;
上的极值;
(Ⅱ)若对任意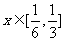 ,不等式
,不等式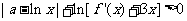 恒成立,求实数
恒成立,求实数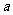 的取值范围;
的取值范围;
(Ⅲ)若函数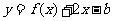 在
在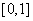 上恰有两个不同的零点,求实数
上恰有两个不同的零点,求实数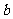 的取值范围。
的取值范围。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com