
7.下列化合物中,只含有一种类型化学键的是
A.Na2O2 B.Ba(OH)2 C.HClO D.CaCl2
8酒精分子的电子式为 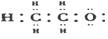 ,按成键原子元素非金属的相对强弱,从左向右两个C的化合价分别为
,按成键原子元素非金属的相对强弱,从左向右两个C的化合价分别为
A.-3,+1 B.+3,-1 C.-3,-1 D.-3,-2
复习重点:离子键、共价键的概念;离子化合物和共价化合物的概念;化学键的概念;
化学反应的实质。
复习难点:化学键的概念;化学反应的实质。
知识梳理
6.(1999年上海)下列化合物中阳离子半径与阴离子半径比值最小的是
A.NaF B.MgI2 C.BaI2 D.KBr
5.根据化学反应的实质是旧键断裂和新键形成这一观点,下列变化于化学反应的是:
A.氯化钠受热熔化 B.石墨在高温高压下转化为金刚石
C.木炭转化为活性炭 D.固态S8加热到444.6℃时变成硫蒸气S2
4.下列各组中的元素,能形成离子键的是
A.C,O B.P,Cl C.Na,F D.K,I
3.下列性质中,可以证明某化合物内一定存在离子键的是
A.可溶于水 B.具有较高的熔点 C.水溶液能导电 D.熔融状态能导电
2.下列化合物中只有共价键的是
A.Na202 B.CaCl2 C.KOH D.NH3
1.关于化学键的下列叙述中,正确的是
A.离子化合物可能含共价键 B.共价化合物可能含离子键
C.离子化合物中只含离子键 D.共价化合物中不含离子键
5.离子半径的比较。同族元素相同价态的离子随核外电子层数的增多离子半径增大(F-<Cl-<Br-<I-,Na+<K+<Rb+<Cs+)。核外电了层结构相同的离子随核电荷数的增加,离子半径减小(O2->F->Na+>Mg2+>Al3+)。
例、现有原子序数之和为51的五种短周元素A、B、C、D、E。已知A的单质在常温下为无色气体;B原子的最外层电子数比次外层电子数多3个;C和B属于同一主族;D的最高正价的代数和为4,其最高价氧化物对应的水化物的酸性在同主族元素中最强,E元素最外层电子数与其K层电子数相同。
①试写出它们的元素符号。
②写出B的氢化物的电子式。
③B的气态氢化物与D的气态氢化物互相作用生成的物质,其电子式为_________或___________.
4.非金属元素的原子间可形成离子化合物。如:NH4Cl、NH4NO3、NH4HCO3等。
3.单质分子中的化学键均为非极性键,化合物分子中可有非极键,离子化合物中
 可存在极性键和非极性键。如N?N(N? N叁键为非极键)H-O-O-H(H-O键为极性键,O-O键为非极性键),Na+[ O O]2-Na (O-O键为非极性键,Na+与O2-间为离子键)
可存在极性键和非极性键。如N?N(N? N叁键为非极键)H-O-O-H(H-O键为极性键,O-O键为非极性键),Na+[ O O]2-Na (O-O键为非极性键,Na+与O2-间为离子键)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com