
14.离子化合的熔点与离子的半径、离子所带的电荷有关,离子的半径越小,离子所带的电荷越高,则离子化合物的熔点就高。NaF、NaI、MgO均为离子化合物,现有下列数据,试判断这三种化合物的熔点高低顺序:
|
物 质 |
① |
② |
③ |
|
离子电荷数 |
1 |
1 |
2 |
|
键长(10-10m) |
2.31 |
3.18 |
2.10 |
A.①>②>③; B.③>①>②; C.③>②>①; D.②>①>③。
13、根据水是极性分子组成的溶剂,试判断下列物质不易溶于水的是: ( )
A、HF B、CH4 C、NaCl D、KBr
12、下列各组顺序的排列不正确的是
A.离子半径:Na+>Mg2+>Al3+>F -; B.热稳定性:HCl>H2S>PH3>AsH3
C.酸性强弱:H3AlO3<H2SiO4<H2CO3<H3PO4; D.溶点:NaCl>SiO2>H2O>CO2
11、下列叙述中正确的是
A.在极性分子中不可能存在非极性键; B.在离子晶体中不可能存在极性键
C.在原子晶体中不可能存在离子键;
D.含有共价键的晶体有的属于分子晶体,有的属于原子晶体,还有的属于离子晶体
11.下列分子中,属于含有极性键的非极性分子是
A.H2O; B.Cl2; C.CCl4; D.CO2
10、下列化合物中所有化学键都是共价键的是:
A.Na2O2; B.NaOH; C.BaCl2; D.H2SO4。
9. 下列变化过程中,共价键被破坏的是
A. 烧碱固体溶于水 B. 氯化氢气体溶于水
C. 二氧化碳变成干冰 D. 碘溶于酒精
8.下列性质中,可以证明某化合物中一定存在离子键的是
A.可溶于水 B.具有较高的熔点
C.水溶液能导电 D.熔融状态能导电
7.下列事实中,能够证明HCl是共价化合物的是:
A.HCl易溶于水; B.液态的HCl不导电;
C.HCl不易分解; D.HCl溶于水能电离,呈酸性。
5、在下列有关晶体的叙述中错误的是
A.离子晶体中,一定存在离子键 B.原子晶体中,只存在共价键
C.金属晶体的熔、沸点的均很高 D.稀有气体的原子能形成分子晶体
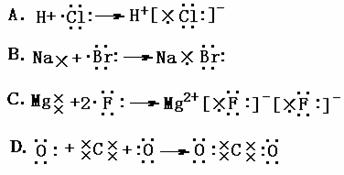 6.下列表示电子式的形成过程正确的是:
6.下列表示电子式的形成过程正确的是:
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com