
数据处理主要包括两方面的内容:
1. 对 进行运算,从而得出测定结果。
4.中和热的测定
中和热是指酸碱中和反应生成 时,所 (选填“吸收”或“放出”)的热量。测定中和热所需的玻璃仪器有 ;要想提高中和热测定的准确性,实验时应注意 。
3.比色法测定自制硫酸亚铁铵的浓度
(1)在定量分析中,通过 来确定 的方法叫比色法。其优点是 ,缺点是 。因此它适用于 ,不适用于 。
(2)测定自制硫酸亚铁铵的浓度时,通常要先配制 ,然后使 ,可测得该待测样品的
Fe3+浓度。
(3)实验中涉及到的原理可用离子方程式表示为 。
思考:实验中,标准溶液的配制对仪器的精确度要求较高,而待测溶液的配制对仪器精确度要求较低,试解释其中原因。
2. 酸碱中和滴定
(1)在定量分析中,用 测定 的叫做酸碱中和滴定。对于一元强酸[c(酸)、V(酸)]和一元强碱[c(碱)、V(碱)]的中和反应,其定量关系为 。
(2)中和滴定实验所需的仪器有 ,药品是 。
(3)滴定前,应做的工作包括:检查滴定管是否漏水、用 洗涤、用 润洗、调整液面至 、取一定体积的 于锥形瓶中;滴定时,左手握 的玻璃旋塞或挤压 的玻璃球的稍上部位,右手摇动 ,眼睛注视 ,当 时即为滴定终点。
1.物质的量浓度溶液的配制与溶液的稀释
(1)配制 100mL 2.0mol·L-1 的NaCl溶液整个过程如下图:
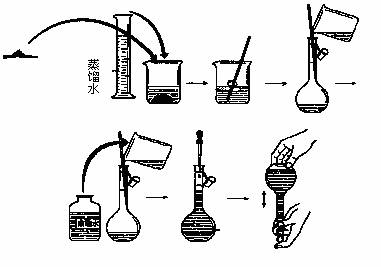
①实验称取的 NaCl 固体的质量为 ;用玻璃棒搅拌的目的是 ;用蒸馏水洗涤烧杯内壁的目的是 ;轻轻振荡容量瓶,使容量瓶中的溶液充分混合的目的是 。
②配好的溶液如何处理?
(2)用 2.0mol·L-1 的NaCl溶液配制 100mL 0.5mol·L-1 的NaCl溶液,需要 2.0mol·L-1 的NaCl溶液的体积是 。
24、100℃时,Kw=10-12,将100℃时pH=10的NaOH溶液和pH=1的H2SO4混合,所得混合溶液的pH=2,则NaOH溶液和H2SO4溶液的体积比是
A、11 : 1 B、9 : 2 C、12 : 11 D、9: 1
23、165℃、1×105Pa下,两气态有机物以任意比例混合,1L该混合物与9LO2混合,充分燃烧后所得气体体积仍为10L,下列各组混合烃中不符合此条件的是
A、CH4、C2H4 B、CH4、C3H6 C、CH3OH、C3H4 D、CH4、C3H4
22、室温时,对于0.1mol·L-1的NH3·H2O,则下列说法正确的是
A、该溶液的pH>13 B、加入等体积0.1mol·L-1盐酸后所得溶液的pH=7
C、该溶液的pH=13 D、加入等体积0.1mol·L-1盐酸后所得溶液的pH<7
21、下列各物质无论以何种比例混合,其碘元素的质量分数不变的是
A、NaIO、 NaI B、NaI、 KI C、NaIO、 KI D、NaIO4、KIO3
20、实验室将NaClO3和Na2SO3按物质的量之比为2:1加入烧瓶中,用水加热,同时滴入H2SO4溶液,产生棕黄色气体X,反应后测得NaClO3和Na2SO3两者均无剩余,则X为
A、Cl2 B、Cl2O C、ClO2 D、Cl2O3
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com