
1.吸氧腐蚀和析氢腐蚀的区别
|
电化腐蚀类型 |
吸氧腐蚀 |
析氢腐蚀 |
|
条件 |
水膜酸性很弱或呈中性 |
水膜酸性较强 |
|
正极反应 |
O2 + 4e- + 2H2O == 4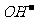 |
2H+ + 2e-==H2↑ |
|
负极反应 |
Fe -2e-==Fe2+ |
Fe -2e-==Fe2+ |
|
总反应方程式 |
4Fe(OH)2+O2+2H2O==4Fe(OH)3 2Fe(OH)3==Fe2O3+3H2O |
Fe + 2H+ = Fe2+
+ H2↑ |
|
腐蚀作用 |
是主要的腐蚀类型,具有广泛性 |
发生在某些局部区域内 |
2.电解原理的应用
(1)电解精炼铜:粗铜作阳极,精铜作阴极,CuSO4溶液作电解质溶液。电解时,发生如下反应:阳极,Cu-2e-=Cu2+,阴极,Cu2++2e-=Cu。阳极泥中存在金、银等不活泼的贵重金属,阴极得到纯铜。
(2)电镀铜:精铜作阳极,镀件金属作阴极,硫酸铜(或其他可溶性铜盐)溶液作电解质溶液,从理论上讲电镀时电解质溶液组成、浓度和质量不变化。电极反应:阳极Cu-2e-=Cu2+,阴极Cu2++2e-=Cu
(3)氯碱工业:阳极2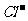 -2e-=Cl2↑, 阴极2H++2e-=H2↑总反应2NaCl+2H2O
-2e-=Cl2↑, 阴极2H++2e-=H2↑总反应2NaCl+2H2O 2NaOH+H2↑+Cl2↑(反应条件:直流电)
2NaOH+H2↑+Cl2↑(反应条件:直流电)
(4)冶炼金属:电解熔融电解质,可炼得活泼金属。如:K、Na、Ca、Mg、Al等金属可通过电解其熔融的氯化物或氧化物制得。电源的负极是最强的“还原剂”,可“强迫”活泼金属的阳离子得电子。如电解冶炼铝:阳极反应6O2--12e-=3O2↑,阴极反应4Al3++12e-=4Al,总反应式为:2Al2O3 4Al+3O2↑。
4Al+3O2↑。
[重点提醒]
(1)电化学计算的基本方法

 原电池和电解池的计算包括两极产物的定量计算、溶液pH的计算、相对原子质量和阿伏加德罗常数测定的计算、根据电荷量求产物的量与根据产物的量求电荷量等的计算。不论哪类计算,均可概括为下列三种方法:
原电池和电解池的计算包括两极产物的定量计算、溶液pH的计算、相对原子质量和阿伏加德罗常数测定的计算、根据电荷量求产物的量与根据产物的量求电荷量等的计算。不论哪类计算,均可概括为下列三种方法:
①根据电子守恒法计算:用于串联电路、阴阳两极产物、正负两极产物、相同电荷量等类型的计算,其依据是电路中转移的电子数相等。
 ②根据总反应式计算:先写出电极反应式,再写出总反应式,最后根据总反应式列比例式计算。
②根据总反应式计算:先写出电极反应式,再写出总反应式,最后根据总反应式列比例式计算。
③根据关系式计算:借得失电子守恒关系建立已知量与未知量之间的桥梁,建立计算所需的关系式。
(2)电化学试题的命题点归纳
①二次电池的充电和放电:放电时原电池,充电时电解池;
②电极名称:原电池的电极名称是正和负极,电解池是阳极和阴极;
③反应类型:负极和阳极发生氧化反应,失电子被氧化,正极和阴极发生还原反应,得电子被氧化;
 ④电极反应:负极的反向是阴极,正极的反向是阳极。酸性电池中不能出现OH-,碱性电池中不能出现H+,非溶液电池不会出现H+和
④电极反应:负极的反向是阴极,正极的反向是阳极。酸性电池中不能出现OH-,碱性电池中不能出现H+,非溶液电池不会出现H+和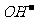 ;
;
⑤溶液和电极附近溶液酸碱性变化:总反应消耗酸(碱),溶液PH增大(减小)。电极反应式中H+(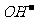 )放电云集
)放电云集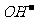 (H+),电极溶液显碱性(酸性)。电极反应消耗H+(
(H+),电极溶液显碱性(酸性)。电极反应消耗H+(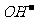 ),酸性(碱性)减弱,生成H+(
),酸性(碱性)减弱,生成H+(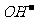 ),酸性(碱性)增强。
),酸性(碱性)增强。
⑥浓度复原:消耗什么补充什么,消耗多少补多少
 电解池是将电能转化为化学能的装置,在电解池中,阳极发生氧化反应、阴极发生还原反应,其放电顺序一般为:阳极:活泼性电极>
电解池是将电能转化为化学能的装置,在电解池中,阳极发生氧化反应、阴极发生还原反应,其放电顺序一般为:阳极:活泼性电极>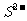 >
>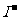 >
>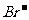 >
>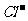 >
>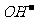 >含氧酸根离子阴极:与金属活动顺序表中金属阳离子的氧化顺序一致
>含氧酸根离子阴极:与金属活动顺序表中金属阳离子的氧化顺序一致
1.(惰性电极)电解电解质溶液的类型
|
类型 |
实例 |
电极反应特点 |
电解对象 |
电解质浓度 |
pH |
溶液复原 |
|
电解水 |
NaOH |
阴:2H++2e-====H2↑ 阳:4 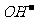 -4e-====2H2O+O2↑ -4e-====2H2O+O2↑ |
水 |
增大 |
增大 |
水 |
|
H2SO4 |
水 |
增大 |
减小 |
水 |
||
|
Na2SO4 |
水 |
增大 |
不变 |
水 |
||
|
电解电解质 |
HCl |
电解质电离出的阴阳离子分别在两极放电 |
电解质 |
减小 |
增大 |
氯化氢 |
|
CuCl2 |
电解质 |
减小 |
- |
氯化铜 |
||
|
放H2生碱 |
NaCl |
阴极:H2O放H2生碱阳极: 电解质阴离子放电 |
电解质 和水 |
生成新电解质 |
增大 |
 氯化氢 氯化氢 |
|
放O2生酸 |
CuSO4 |
阴极:电解质阳离子放电 阳极:H2O放O2生酸 |
电解质 和水 |
生成新电解质 |
减小 |
氧化铜 |
3.原电池原理的应用
(1)利用原电池原理可以制造出各种实用电池,即化学电源,如锌锰干电池、铅蓄电池、锂电池、新型燃料电池等。
(2)原电池原理可用于解决一些实际问题,如加快某些化学反应时的速率(稀硫酸与锌反应时,常滴入几滴硫酸铜溶液);分析金属电化学腐蚀的快慢和防护方法等。
[重点提醒]
(1)由电极装置书写电极反应:找出发生氧化反应和还原反应的物质(或离子),确定正负或阴阳极反应的物质(或放电的离子),利用电荷守恒分别写出电极反应式。
 (2)差值法书写电极反应式:正负(或阴阳)极反应式之和为电池反应的方程式。一般先写出反应的总方程式和较易写出的电极反应式,然后用总方程式减去较易写出的电极反应式得较难写的电极反应式。书写时,无论是总反应式还是电极反应式都既要满足电子转移守恒、电荷守恒,又要满足质量守恒。书写时注意介质通常是定向移动到该电极附近的导电离子如H+、OH-、H2O等等,若氧化(或还原)产物能与之发生复分解反应,则其一般书写在电极方程式中
(2)差值法书写电极反应式:正负(或阴阳)极反应式之和为电池反应的方程式。一般先写出反应的总方程式和较易写出的电极反应式,然后用总方程式减去较易写出的电极反应式得较难写的电极反应式。书写时,无论是总反应式还是电极反应式都既要满足电子转移守恒、电荷守恒,又要满足质量守恒。书写时注意介质通常是定向移动到该电极附近的导电离子如H+、OH-、H2O等等,若氧化(或还原)产物能与之发生复分解反应,则其一般书写在电极方程式中
(3)常见电极反应式
(a)氢、氧燃烧电池(电池的产物负极为H2O,正极则有大量的氢氧根生成):
负极: 正极:
正极: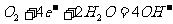
(b)甲烷燃烧电池(电池负极甲烷燃烧失去电子,在碱性条件下生成的CO2与OH-反应生成CO32-和H2O, 而正极是 O2得到电子而成为OH-。)
负极: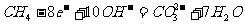 正极:
正极: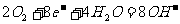
(c)爱迪生蓄电池: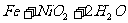
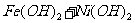
负极: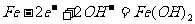
 正极:
正极: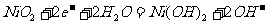
(d)纽扣电池: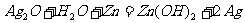
负极: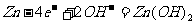 正极:
正极: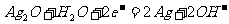
 (e)铅蓄电池
(e)铅蓄电池
负极: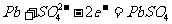
正极:
2.原电池正极和负极的确定
(1)由两极的相对活泼性确定:在原电池中,相对活泼性较强的金属为原电池的负极,相对活泼性较差的金属或导电的非金属作原电池的正极。
 (2)由电极现象确定:通常情况下,在原电池中某一电极若不断溶解或质量不断减少,该电极发生氧化反应,此为原电池的负极;若原电池中某一电极上有气体生成、电极的质量不断增加或电极质量不变,该电极发生还原反应,此为原电池的正极。
(2)由电极现象确定:通常情况下,在原电池中某一电极若不断溶解或质量不断减少,该电极发生氧化反应,此为原电池的负极;若原电池中某一电极上有气体生成、电极的质量不断增加或电极质量不变,该电极发生还原反应,此为原电池的正极。
原电池是一种由化学能转变成电能的装置。其本质是通过自发进行的氧化还原反应,使反应中电子转移而产生电流,反应中的氧化反应和还原反应分别在两个电极上发生,这便形成了带电粒子按一定方向流动的闭合回路
1.原电池的判定
先分析有无外接电源,有外接电源者为电解池,无外接电源者可能为原电池;再依据原电池的形成条件分析判定,主要思路是“三看”:一看电极,两极为导体且活泼性不同;二看溶液,两极插入电解质溶液中;三看回路:形成闭合回路或两极接触。
5、理解是生活的太阳,她将给人们带来无尽的温暖。理解是生活的发动机,她将给人们带来无穷的力量;理解是生活的美酒,她将给人们带来醉人的芳香。
4、A是一座金字塔,是进取;B是两个连接在一起的心,是友谊;C是未满的月牙,是缺憾。X是人生的交叉路口,是选择;F是一根拐杖,是帮扶;H是互相牵着的手,是真情;W是崎岖的山路,是坎坷。0是一面镜子,让你认识自己;O是一只漂流圈,让弱者随波逐流一面敲响的战鼓,催强者奋勇前进;一块空地,让勤劳者自由地耕种五谷。
3、倾听春天的莺歌燕语,我们感受到生命的活力,意境的优美;倾听大海的潮起潮落,我们感受到激越的乐章和壮美的境界;倾听长者的教诲,我们如坐春风;倾听朋友的诉说,我们感觉到友谊的可贵……
2、“指点江山,激扬文字”是一种豪迈的潇洒,“天生我材必有用”是一种自信的潇洒,“独钓寒江雪”是一种高洁的潇洒,“不破楼兰终不还”是一种悲壮的潇洒。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com